肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种进行性、致死性的运动神经元疾病,至今尚无有效治愈手段[1]。研究发现,约有20%的家族性ALS病例以及2%散发病例是由超氧化物歧化酶基因(superoxide dismutase 1,Sod1)显性突变导致[2]。G85R是Sod1基因点突变的一种,线虫转G85R-Sod1基因后可导致神经突触泡生物生成和转运紊乱而出现运动能力减弱[3]。此外,有证据表明叶酸在ALS的预防和治疗方面表现出积极的作用,如叶酸单独用药及叶酸和维生素B12联合用药能够显著降低G93A-Sod1 ALS模型小鼠血浆同型半胱氨酸(homocysteine,Hcy)的水平,延缓疾病的发生和延长模型小鼠的生存时间[4]。本研究将分别构建G85R-Sod1:YFP与叶酸代谢相关5-甲酰四氢叶酸环连接酶(5-formyltetrahydrofolate cyclo-ligase,Y106G6E.4)、蛋氨酸合成酶(methionine synthase,R03D7.1)和四氢叶酸脱氢酶(5,10-methenyl-tetrahydrofolate synthetase,Dao-3)基因缺失的双突变体并检测各突变体的运动能力,以明确叶酸代谢在ALS线虫病理发展中的作用。 1 材料与方法 1.1 实验对象
野生型秀丽隐杆线虫(C.elegans,the Bristol strain,N2)株系,尿嘧啶渗漏突变型大肠杆菌OP50,G85R-Sod1:YFP为人突变型Sod1转基因线虫模型由Johns Hopkins University,Dr.Wang惠赠,本实验室保存。VC2322(Y106G6E.4),RB755(R03D7.1)和VC1197(Dao-3)突变株系购自美国Caenorhabditis Genetics Center。 1.2 秀丽隐杆线虫培养
线虫的培养使用线虫标准培养基(nematode growth medium,NGM)。使用E.coli OP50作为线虫食物。线虫于生化培养箱培养,培养温度为20 ℃。 1.3 G85R/VC2322、G85R/RB755、G85R/VC1197双突变体株系构建
每次分别挑取8只N2雄虫与5只G85R::YFP雌雄同体线虫放入同一个培养皿中进行交配培养。3 d后取带有绿色荧光F1雄虫,分别与VC2322、RB755和VC1197雌雄同体线虫交配,此次交配计为回交1次(×1),将F2代(含有YFP)雄性线虫再次分别回交VC2322、RB755、VC1197(×2),得到F3雄虫(含有YFP),再次分别回交VC2322、RB755、VC1197(×3),将F4(含有YFP)线虫进行PCR鉴定分别得到Y106G6E.4、R03D7.1和Dao-3基因纯合的突变体。以上基因的纯合体雌雄同体自交,最后通过荧光强度鉴定,得到同时为双拷贝Sod1基因纯合的双突变体。线虫交配具体流程图和遗传图如图 1所示(以G85R/VC1197双突变体构建为例)。
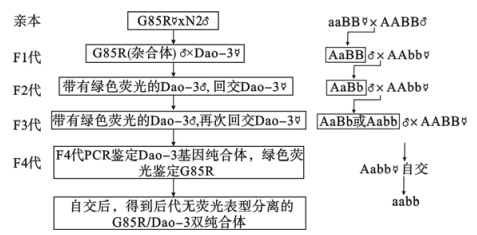 | A:Sod1基因;B:Dao-3基因;a:Sod1突变基因;b:Dao-3突变基因。 图 1 双突变体构建流程和遗传图 |
挑取1只线虫放入20 μL含蛋白酶K(终浓度为250 μg/mL)的裂解缓冲液(配方:50 mmol/L KCl,10 mmol/L Tris-HCl(pH 8.3),2.5 mmol/L MgCl2,0.45% Nonidet P-40,0.45% Tween 20)中,于50 ℃水浴15 min、90 ℃水浴10 min、4 ℃保存。裂解的线虫溶液可作为PCR扩增的模板。 1.4.2 引物设计
在wormbase(http://www.wormbase.org/)上分别找到Y106G6E.4、R03D7.1和Dao-3基因序列,用primer 3软件设计相应基因的PCR扩增引物。Dao-3引物: P1:gctcacgctcaaaacatgaa,P2:tcttctcatcactcccccac;R03D7.1引物:P1: cgaggatgaaggagttccag,P2:ctgatgcagctggaagcata;Y106G6E.4 引物:P1:cacctcggaaggctagaatgc,P2:ccgatccctgacgatatcaa。 1.4.3 PCR反应
线虫PCR反应同常规PCR。95 ℃预变性5 min,后94 ℃ 30 s,58 ℃ 45 s,72 ℃ 120 s进行30个循环,72 ℃ 10 min。凝胶成像分析系统将电泳后的琼脂糖凝胶拍照并分析。 1.4.4 线虫运动能力检测
将线虫转移到已接种有OP50新的NGM平板上,转移后线虫将在短时间内具有最大的移动距离。用录像方法记录每个线虫转移后30 s的活动距离,计算移动距离/身长比值作为其移动指数。将处于L4幼虫期的线虫转移到20 ℃条件下M9缓冲液(每升缓冲液含有3 g KH2PO4,6 g Na2HPO4,5 g NaCl,1 mL 1 mmol/L MgSO4),让其适应1 min后,计数在1 min内线虫身体在缓冲液中的摆动次数。 1.5 统计分析
采用SPSS 16.0软件进行单因素方差分析,若组间差异有统计学意义,各组间两两比较采用SNK-q检验,检验水准α=0.05。 2 结 果 2.1 G85R/VC1197、G85R/VC2322、G85R/RB755双突变体Sod1基因鉴定(图 2)
通过观察杂交F4代个体的绿色荧光强弱判断双突变体中Sod1基因的拷贝情况,Leica MZ16F体式显微镜下荧光鉴定结果如图 2,强荧光为双拷贝Sod1基因纯合体,弱荧光为单拷贝的基因杂合体。
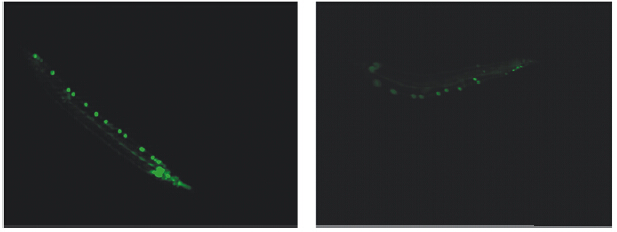 | 注:左图为Sod1双拷贝基因纯合体,右图为Sod1单拷贝的杂合体。 图 2 Leica MZ16F体式显微镜下杂交F4代个体Sod1基因的荧光鉴定(63×,50 ms) |
将F4代带有绿色荧光的雌雄同体个体进行单线虫PCR鉴定。预期Dao-3基因缺失突变体的扩增片段1 515 bp,野生型片段大小3 014 bp;Y106G6E.4基因缺失突变体的扩增 片段1 077 bp,野生型片段大小1 445 bp;R03D7.1突变体的扩增片段230 bp,野生型片段大小3 182 bp。如图 3所示,以上3个基因野生型、突变型和杂合型扩增片段均与预期扩增片段大小一致。
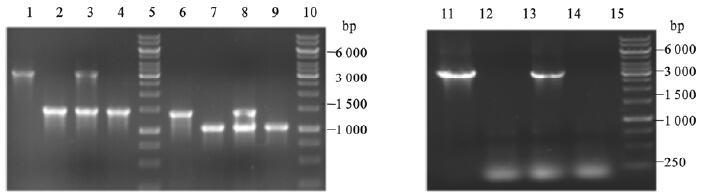 | 注:野生型、突变体亲本、F4代杂合个体、F4代纯合个体Dao-3基因扩增片段泳道为1、2、3、4,Y106G6E.4基因扩增片段泳道为6、7、8、9,R03D7.1基因扩增片段泳道为11、12、13、14,DNA marker泳道为5、10、15。 图 3 Y106G6E.4、R03D7.1和Dao-3基因单线虫基因组PCR鉴定 |
为考察叶酸代谢相关基因突变对秀丽隐杆线虫运动能力的影响,分析各双突变体线虫在M9培养液中每分钟摆动次数,进行单因素方差分析。结果表明,与N2对照组(176.4±11.59)次/min比较,转基因ALS线虫G85R-Sod1(32±4.34)身体摆动能力受到严重影响(P<0.05);与G85R-Sod1线虫比,3种双突变体G85R/VC2322(14.6±2.39)、G85R/RB755(17.4±2.23)和G85R/VC1197(10.2±1.64)的身体摆动能力均明显降低(P<0.05)。
| 表 1 Y106G6E.4、R03D7.1和Dao-3基因突变对ALS线虫身体摆动、移动能力的影响(x±S,n=4) |
对双突变体线虫在NGM平板上的移动能力进行方差分析。 结果表明,与N2对照组(90±5.10)相比,转基因ALS线虫G85R-Sod1(29.25±2.87)在NGM平板上的相对移动距离(移动距离/身长长度)明显缩短(P<0.05);与G85R-Sod1线虫比,3种双突变体G85R/VC2322(22.25±3.59)、G85R/RB755(23.25±3.30)和G85R/VC1197(21.5±2.07)的身体摆动能力均受到进一步损害(P<0.05)。 3 讨 论
秀丽隐杆线虫是神经毒理学及神经退行性疾病研究的适宜模型生物[5]。其虫体小,通体透明,易在显微镜下对活体组织和细胞进行跟踪观察,尤其是可以借助绿色或红色荧光标记,通过其荧光强度判断基因的表达水平。在本实验中使用YFP标记G85R转基因线虫,较易筛选后代Sod1基因阳性表达,大大缩短了双突变体线虫的筛选时间。
对 ALS病理机制的深入探讨和有效治疗药物的研发是目前乃至今后世界医学的难点热点。研究表明,ALS的发病机制极其复杂,可能涉及到基因突变、氧化应激、线粒体功能障碍、神经营养因子缺乏等各个方面[6]。大量证据表明,叶酸及其代谢在神经管畸形[7, 8]和神经退行性疾病[9]发生发展过程中起重要作用并影响神经干细胞增殖分化[10],但目前叶酸在运动神经元疾病ALS病理进程中的作用研究较少,仅有动物实验证明叶酸对ALS疾病模型小鼠具有保护作用[4]。另外鉴于血浆Hcy和叶酸浓度呈负相关,而在ALS病患脑中发现Hcy的增高[11],这可能是叶酸具有ALS保护作用的另一重要间接证据。本研究发现与叶酸相关体内代谢改变可加重ALS病情,为叶酸对ALS疾病可能的神经保护作用提供实验依据。
蛋氨酸合成酶,四氢叶酸脱氢酶和5-甲酰四氢叶酸环连接酶等均是叶酸相关一碳单位代谢通路中重要的酶,而一碳代谢途径与嘌呤、胸苷核苷酸和氨基酸(特别是含硫氨基酸)代谢密切相关。基于RNA加工异常和含硫氨基酸如牛磺酸增多可能为ALS发病的起始事件,故推测叶酸依赖型一碳单位的代谢可能涉及 ALS疾病进程。本实验结果表明,三个叶酸代谢相关酶基因突变均可加重ALS Sod1模型线虫的运动损伤,说明叶酸代谢改变可能是该病发生发展的重要病理机制之一。另外由于ALS的发病机制十分复杂,要完全明确运动神经元损害的机制与叶酸代谢之间的关系尚需要进行大量的工作。
| [1] | 包建玲,黄红云.肌萎缩性侧索硬化症动物模型的应用进展[J].生物技术通讯,2008,19(2):310-312. |
| [2] | Rosen DR,Siddique T,Patterson D,et al.Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis[J].Nature,1993,362:59-62. |
| [3] | Wang J,Farr GW,Hall DH,et al.An ALS-linked mutant SOD1 produces a locomotor defect associated with aggregation and synaptic dysfunction when expressed in neurons of Caenorhabditis elegans[J].PLoS Genet,2009,5(1):e1000350. |
| [4] | Zhang X,Chen S,Li L,et al.Folic acid protects motor neurons against the increased homocysteine,inflammation and apoptosis in SOD1 G93A transgenic mice[J].Neuropharmacology,2008,54(7):1112-1119. |
| [5] | 李煜,敬海明,李国君.秀丽隐杆线虫神经毒理学研究进展[J].中国公共卫生,2013,29(4):622-624. |
| [6] | Bruijn LI,Miller TM,Cleveland DW.Unraveling the mechanisms involved in motor neuron degeneration in ALS[J].Annu Rev Neurosci,2004,27:723-749. |
| [7] | Jagerstad M.Folic acid fortification prevents neural tube defects and may also reduce cancer risks[J].Acta Paediatr,2012,101(10):1007-1012. |
| [8] | 陈云霞,武延隽,申丽丽.育龄女性叶酸代谢相关酶基因多态性分析[J].中国公共卫生,2010,26(8):958-959. |
| [9] | Reynolds EH.The neurology of folic acid deficiency[J].Handb Clin Neurol,2014,120:927-943. |
| [10] | 王广雷,黄国伟,张绪梅,等.叶酸对胎鼠大脑神经干细胞增殖蛋白表达影响[J].中国公共卫生,2008,24(4):462-464. |
| [11] | 王宏利,樊东升.血浆同型半胱氨酸水平和肌萎缩侧索硬化症的关系[J].中华内科杂志,2012,51(4):308-310. |
 2014, Vol. 30
2014, Vol. 30


