2. 牡丹江医学院药学院;
3. 牡丹江医学院第二附属医院
糖尿病心肌病(diabetic cardiomyopathy,DCM)作为糖尿病并发的心血管疾病,是一种特异的心肌疾病。其病理改变主要表现为心肌细胞肥大、变性、坏死,肌丝纤维大量丢失,心肌细胞外间质有不溶性胶原蛋白积聚、纤维化[1]。糖尿病心肌病作为糖尿病和心脏病方面的过渡病种,越发受到人们的关注。近年来发现的微小RNA(microRNA,miRNA)在基因的转录后调解中发挥着重要作用。目前实验证实miRNA在心血管系统病理过程中发挥重要作用,包括心律失常、心肌肥大、心肌纤维化、心肌梗死[2, 3, 4]等。因此miRNA已成为相关疾病治疗的新靶点,疾病诊断、预防和治疗的重要工具[5, 6]。本研究应用链尿佐菌素诱导小鼠建立糖尿病动物模型,运用实时定量PCR(qRT-PCR)技术检测心肌组织中差异miRNA表达,并对部分靶基因进行检测,探讨miRNA在糖尿病心肌病病理过程中的作用。 1 材料与方法 1.1 主要试剂与仪器
链脲佐菌素(美国Sigma公司),One touch II血糖仪(美国强生公司),BX51显微镜(美国Olympus公司),Trizol试剂(美国Invitrogen公司),miRNeasy Mini kit(美国Ambion公司),NanoDrop2000(美国Thermo公司),2100生物分析仪器(美国Agilent公司),RT2 miRNA PCR Arrays Mouse Mifinder(美国Qiagen公司),7900HT PCR仪器(美国ABI公司)。 1.2 动物分组及模型建立
12只8周龄雄性C57BL/6小鼠(北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001),体重23~25 g,动物适应饲养l周后,随机分为2组,对照组及糖尿病模型组,模型组一次性腹腔注射链脲佐菌素150 mg/kg,对照组注射等量柠檬酸缓冲液,自由饮水与摄食,室温18~20 ℃,湿度69%,12 h交替照明。48 h后采用血糖仪测血糖,血糖≥16.7 mmol/L即确认为糖尿病建模成功[7]。模型成功后6周处死小鼠,一部分心肌组织固定,另一部分心肌组织-80 ℃保存备用。 1.3 指标与方法 1.3.1 心肌组织学检查
取小鼠左心室心肌组织,用10%磷酸盐缓冲液-中性甲醛固定液固定,脱水、清洗、石蜡包埋后制成切片,苏木素-伊红染色(hematoxylin-eosin staining,HE),光学显微镜观察心肌细胞形态学改变。 1.3.2 心肌组织总RNA提取及质量鉴定
按照Trizol试剂说明书步骤,提取心肌组织总RNA,用miRNeasy Mini kit纯化总RNA,获得miRNA。应用Nanodrop2000测定总RNA/miRNA的浓度及纯度,并使用2100生物分析仪器进一步检测总RNA/miRNA质量。 1.3.3 心肌组织差异miRNA表达检测
采用RT2 miRNA PCR Arrays Mouse Mifinder试剂盒对miRNA 进行检测,根据总miRNA浓度,每个样品取100 ng总miRNA,使用RT2 Easy First Strand Kit合成cDNA(操作按照说明书),反应程序:37 ℃孵育2 h,95 ℃5 min,冰浴10 min,用RNase-free H2O 10倍稀释,储存于-20 ℃;将cDNA模板100 μL与2X RT2 SYBR Green qPCR Master Mix 1 275 μL,ddH2O补充至体积2 550 μL,将等体积混合液分配到96孔板中,反应体系25 μL,ABI 7900HT PCR仪器,反应程序为:95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火1 min;72 ℃延伸30 s,扩增40个循环。 利用ABI PRISM 7700 Sequence Detection System导出原始数据上传至Qiagen公司提供的在线分析软件(http://pcrdataanalysis.sabiosciences.com/pcr/arrayanalysis.php)分析数据,筛选出差异表达的miRNA。 1.3.4 差异miRNA靶基因预测及功能分析
采用生物信息学分析方法,利用TargetScan、PicTar和miRanda分析软件预测并初步分析差异表达miRNAs的靶基因并分析其功能。 1.3.5 qRT-PCR检测差异miRNA靶基因表达
取2 μg mRNA逆转录为cDNA(按照试剂盒说明书操作),PCR反应体系 20 μL,其中SYBR Green 10 μL,上游引物 (10 μmol/L) 和下游引物 (10 μmol/L) 各 1 μL,cDNA 1 μL,ddH2O 7 μL。 PCR扩增参数为:95 ℃预变性10 min;95 ℃变性15 s;60 ℃ 退火1 min;扩增40个循环。每份标本做2个平行样,内参基因为Rps16。扩增引物序列见表 1。
| 表 1 扩增引物序列 |
实验数据以x±s表示,采用GraphPad 5.0统计软件进行统计处理,组间比较采用t-test,特异表达miRNA采用公司提供的软件分析,P<0.05表示差异有统计学意义。 2 结 果 2.1 糖尿病模型小鼠的血糖及一般状况
糖尿病模型组小鼠呈明显多饮、多食、多尿症状,并伴有不同程度精神萎靡,对照组小鼠状况良好,2组小鼠均无死亡。与对照组小鼠体重[(19.83±0.85)g]、血糖[(7.0±0.6) mmol/L]比较,糖尿病模型组小鼠体重[(24.98±0.30)g]和血糖[(20.9±4.1)mmol/L]明显升高(P<0.01)。糖尿病模型组小鼠心脏/体重比[(5.30±0.96) mg/g]高于对照组[(6.21±0.16) mg/g](P<0.01)。表明糖尿病心肌病小鼠模型建立成功。 2.2 糖尿病模型组小鼠心肌组织学改变(图 1)
心脏组织学观察显示,对照组小鼠心肌纤维排列整齐,分布比较均匀(图 1A),糖尿病模型组小鼠心肌横切面可见心肌细胞增大,排列较紊乱,细胞核增大并深染(图 1B)。
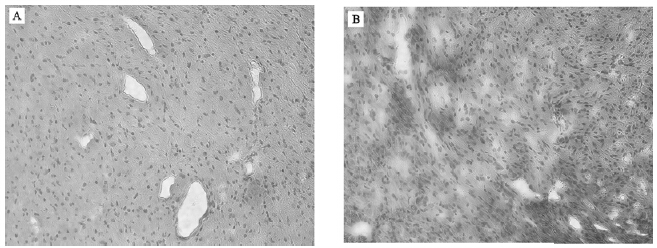 | 注:A:对照组,B:糖尿病模型组。 图 1 小鼠心肌病理形态学改变(HE,200×) |
采用NanoDrop2000测定总RNA浓度,A260/280值在1.8~2.0,A260/230>1.8,表明核酸纯度较高;采用2100生物分析仪测定总RNA完整性,核算完整性RIN均为10,表明RNA/miRNA无降解,质量可靠,可以满足后续的miRNA芯片检测和实时定量PCR的实验要求。 2.3.2 心肌组织差异表达的miRNAs及其靶基因预测(表 2)
基因芯片检测显示,与对照组比较,模型组小鼠心肌组织中有13个miRNA存在不同程度改变,其中miR-19a、miR-19b、miR-22、miR-503,miR-467e表达上调,miR-1、miR-29a、miR-30a、miR-96、miR-101a、miR-142-3p、miR-199-5p、miR-374表达下调。利用TargetScan、miRanda和PicTar分析软件对差异表达的miRNA可能调控的靶基因进行初步预测显示,其生物学功能主要与细胞增殖、凋亡和分化、炎症反应以及胶原形成密切相关。
| 表 2 差异表达miRNAs的主要靶基因 |
与对照组比较,糖尿病模型组小鼠心房钠尿肽(BNP)、β-肌球蛋白重链(Myh7)、细胞周期素D1(Ccnd1)表达明显升高,组蛋白去乙酰化酶(Hdac1)、Ⅰ型胶原蛋白(Col1A1)、血管细胞粘附因子1(Vcam1)表达明显降低,差异均有统计学意义(P<0.05)。
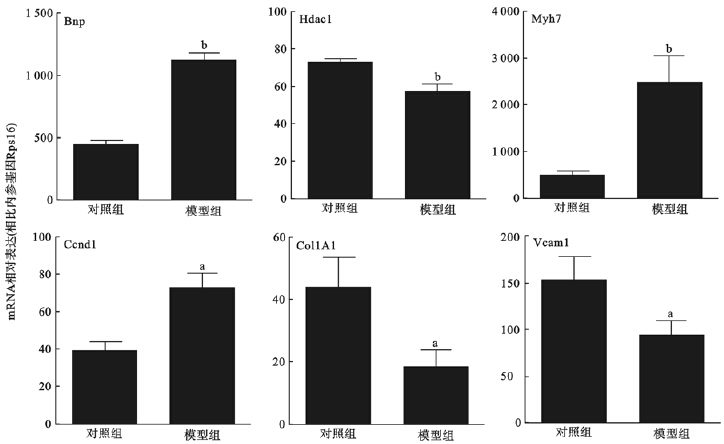 | 与对照组比较,a P<0.05,b P<0.01 图 2 对照组与糖尿病模型组小鼠心肌组织mRNA表达变化 |
糖尿病心肌病是指糖尿病患者心肌细胞原发性损伤引起广泛的结构异常,最终引起左心室肥厚、舒张期和(或)收缩期心脏功能障碍的一种疾病状态,是导致糖尿病晚期死亡的主要原因之一[1]。近年来发现的miRNA 能在基因转录后水平通过与靶基因mRNA完全或不完全互补结合的方式降解其mRNA链或阻碍其蛋白翻译过程,从而发挥生物学功能[5]。本研究结果显示,与对照组比较,糖尿病模型组小鼠心肌组织中有13个miRNA存在不同程度改变,,其中,miR-1、miR-22、miR-503在心脏疾病的病理过程中具有重要的调节作用。研究发现过表达miR-1能够降低心肌细胞的大小以及心肌肥大细胞的分子标记,推测miR-1在心肌细胞肥大和心肌纤维化过程中具有重要作用[8],糖尿病心肌病发病过程中可能是由miR-1/206通过调控靶基因IGF-1起作用[9]。miR-22是目前发现的另一种与心肌肥大和纤维化相关的miRNA。在苯肾上腺素或血管紧张素Ⅱ诱导的大鼠心肌细胞中,miR-22上调可引起心肌细胞肥大及Myh表达下调,而通过抑制靶蛋白PTEN下调miR-22表达可有效防止大鼠心肌细胞肥大[10],另有研究发现miR-30家族在小鼠肥厚性心脏和病人心脏中显著上调[11],长期慢性饮酒导致小鼠心脏肥大,miR-30a显著下调[12],miR-30有可能成为诊断左心室肥大的重要分子标记[13]。miR-101a/b在大鼠心肌梗死组织中显著下调[14]。 本研究中尚未发现miR-133表达变化,但有研究表明其主要参与后期肥厚性增长的病理过程,而不参与早期的细胞快速增长,具体机制尚有待进一步研究[15]。
本研究利用TargetScan、miRanda和PicTar分析软件对差异表达的miRNA可能调控的靶基因进行了初步预测,结果显示,其生物学功能主要涉及细胞增殖、凋亡 和分化、炎症反应以及胶原形成等;采用心肌肥大或者与心肌纤维化相关基因,如:BNP、Myh7、Hadc1、Col1A1、Ccnd1、Vcam1进行qRT-PCR检测发现,这些靶基因在糖尿病小鼠心肌组织中存在不同程度的表达变化,差异有统计学意义(P<0.05)。提示差异表达的miRNA可能通过这些靶基因调控糖尿病心肌病的发病过程。 然而,仍有大量预测靶基因及其功能需要实验加以验证,主要原因在于miRNA参与和调控生物学功能的多样性和复杂性。
| [1] | Asghar O,Al-Sunni A,Khavandi K,et al.Diabetic cardiomyopathy[J].Clin Sci(Lond),2009,116(10):741-760. |
| [2] | Da Costa Martins PA,De Windt LJ.MicroRNAs in control of cardiac hypertrophy[J].Cardiovasc Res,2012,93(4):563-572. |
| [3] | Papageorgiou N,Tousoulis D,Androulakis E,et al.The role of microRNAs in cardiovascular disease[J].Curr Med Chem,2012,19(16):2605-2610. |
| [4] | Fiedler J,Thum T.MicroRNAs in myocardial infarction[J].Arterioscler Thromb Vasc Biol,2013,33(2):201-205. |
| [5] | Pan ZW,Lu YJ,Yang BF.MicroRNAs:a novel class of potential therapeutic targets for cardiovascular diseases[J].Acta Pharmacol Sin,2010,31(1):1-9. |
| [6] | 周世权,张艳炜,董秋实,等.miRNA与心脑血管病研究进展[J].中国公共卫生,2014,30(3):378-380. |
| [7] | Matteucci E,Giampietro O.Proposal open for discussion:defining agreed diagnostic procedures in experimental diabetes research[J].J Ethnopharmacol,2008,115(2):163-172. |
| [8] | Sayed D,Hong C,Chen IY,et al.MicroRNAs play an essential role in the development of cardiac hypertrophy[J].Circ Res,2007,100(3):416-424. |
| [9] | 刘洁婷,李洪志,吴丹,等.糖尿病心肌病与miR-1/miR-206 和胰岛素样生长因子表达的关系[J].中国生化药物杂志,2012,(33)4:389-391. |
| [10] | Xu XD,Song XW,Li Q,et al.Attenuation of microRNA-22 derepressed PTEN to effectively protect rat cardiomyocytes from hypertrophy[J].J Cell Physiol,2012,227(4):1391-1398. |
| [11] | Duisters RF,Tijsen AJ,Schroen B,et al.miR-133 and miR-30 regulate connective tissue growth factor:implications for a role of microRNAs in myocardial matrix remodeling[J].Circ Res,2009,104(2):170-178. |
| [12] | Guo R,Hu N,Kandadi MR,et al.Facilitated ethanol metabolism promotes cardiomyocyte contractile dysfunction through autophagy in murine hearts[J].Autophagy,2012,8(4):593-608. |
| [13] | Pan W,Zhong Y,Cheng C,et al.MiR-30-regulated autophagy mediates angiotensin II-induced myocardial hypertrophy[J].PLoS One,2013,8(1):e53950. |
| [14] | Pan Z,Sun X,Shan H,et al.MicroRNA-101 inhibited postinfarct cardiac fibrosis and improved left ventricular compliance via the FBJ osteosarcoma oncogene/transforming growth factor-beta 1 pathway[J].Circulation,2012,126(7):840-850. |
| [15] | Busk PK,Cirera S.MicroRNA profiling in early hypertrophic growth of the left ventricle in rats[J].Biochem Biophys Res Commun,2010,396(4):989-993. |
 2014, Vol. 30
2014, Vol. 30


