2. 中国疾病预防控制中心病毒病预防控制所
流行性乙型脑炎病毒(epidemic encephalitis B virus)又称日本脑炎病毒(Japanese encephalits virus,JEV),可引起以中枢神经系统损害为主的急性传染病,在中国多省均有流行报道[1, 2]。JEV是黄病毒科黄病毒属的成员,为单股正链RNA病毒,基因组长约ll kb,基因结构为含5′和3′非编码区、3个结构基因编码3种结构蛋白和7个非结构基因编码7种非结构蛋白,其排列顺序为5′ NCR-C- PrM/M-E-NS1- NS2B-NS3-NS4A-NS4B-NS5-3′NCR。其中的NS1蛋白是一种非结构分泌型糖蛋白,在黄病毒蛋白中高度保守,可诱导机体产生抗体,在黄病毒的致病机理中也可能发挥作用[3, 4]。本研究采用大肠杆菌系统表达乙脑病毒NS1蛋白,并对表达产物进行免疫原性分析,在疫苗研制、诊断试剂开发等方面均具有重要意义。 1 材料与方法 1.1 材料
乙型脑炎病毒SA14-14-2株由成都生物制品研究所提供,BHK-21细胞、原核表达载体pET30a 、宿主菌 DH5α、BL21(DE3)由中国疾病预防控制中心病毒病所出血热室保存,新西兰大白兔1只,重量2.1kg,购自中国医学科学院实验动物学研究所(动物合格证号SCXK(京)2007-0003)。 1.2 主要仪器与试剂
TRIzol Reagent、SuperScript III第一链合成试剂盒、Platinum Pfx DNA 聚合酶(美国Invitrogen公司),限制性内切酶、T4 DNA连接酶(美国Biolab公司),DNA纯化试剂盒(美国QIAGEN公司),质粒提取试剂盒(美国Omega公司),乙脑病毒免疫的鼠多克隆腹水(中国疾病预防控制中心病毒病所出血热室制备),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记抗兔IgG抗体、辣根过氧化物酶(hydrogen-peroxide oxidoreductase,HRP)酶标抗兔IgG 抗体(德国Sigma公司)。引物合成由上海生工生物工程公司完成。 1.3 方法 1.3.1 细胞及病毒培养
BHK-21细胞用含10%小牛血清的Eagle′s培养至单层时,接种乙脑病毒SA14-14-2株,37 ℃、5%CO2条件培养,逐日观察,待90%细胞出现病变时,收集培养细胞用于提取病毒RNA。 1.3.2 病毒RNA的提取及cDNA第一链的合成
使用Gibco公司的Trizol Reagent提取。获得的病毒RNA用30 μL无RNA酶的纯水重悬。病毒cDNA第一链的合成采用Invitrogen公司SuperScript III第一链合成试剂盒,操作按说明书进行。 1.3.3 NS1基因的扩增及重组表达质粒的构建
以JEV病毒cDNA为模板,采用Platinum Pfx DNA 聚合酶扩增JEV NS1基因。扩增上游引物P1为:5′-GGAATTCCATATGGACACTGGAT GTGCCATTGAC-3′(下划线为NdeⅠ酶切位点,并含ATG起始密码子);下游引物为:CCGCTCGAGTTAATGGTGATGGTGATGGTGAGCAGCGACTAGCACCACAT-3′(下划线为Xho Ⅰ酶切位点,引入TAA终止密码子)。扩增条件为:94 ℃预变性30 s,94 ℃ 15 s,52 ℃ 30 s,68 ℃ 1.5 min,共30个循环,68 ℃延伸10 min,4 ℃保存。PCR产物采用1%琼脂糖凝胶电泳检测并纯化回收。NS1基因PCR产物与克隆载体pET30a用NdeⅠ和Xho Ⅰ双酶切,酶切产物纯化回收后采用T4 DNA连接酶定向连接,连接产物转化大肠杆菌H5α。小量制备质粒后并进一步经酶切和测序鉴定(测序工作由北京三博远志生物技术有限责任公司完成)。重组表达质粒命名为pET30a-JEV NS1。将鉴定正确的质粒转化BL21(DE3)菌株,于-40 ℃保存菌种。 1.3.4 重组蛋白在大肠杆菌中的表达和纯化
将含pET30a-JEV NS1重组质粒的BL21(DE3)菌种接种卡那霉素抗性的培养基37 ℃培养至OD600约为0.6时,加入异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG)至终浓度1mmol/L,37 ℃继续培养5 h,收集菌体。超声裂解,离心后用8 mol/L尿素溶解沉淀,溶解上清过HiTrap Chelating HP Ni+亲和层析柱,采用不同浓度咪唑洗脱,收集有洗脱峰的洗脱液。洗脱液进一步在含尿素为7、6、5、4、3、2、1、0 mol/L 的透析缓冲液中透析复性。纯化后蛋白进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和Western bolt分析。 1.3.5 重组蛋白多克隆抗体的制备及检测
取重组JEV NS1蛋白免疫新西兰大白兔,免疫方法为皮下及肌肉多点注射,免疫剂量为200 μg/次,共免疫4次,每次间隔1周。首次免疫使用弗氏完全佐剂,加强免疫使用弗氏不完全佐剂。末次免疫1周后采集兔颈动脉血,分离血清。免疫前取耳缘静脉血作阴性对照。免疫血清的检测:(1)间接enzyme-linked immunosorbent assay(ELISA):以重组JEV NS1蛋白包被96孔板,100 ng/孔,一抗为经磷酸盐缓冲液(phosphate buffered saline,PBS)系列稀释的兔免疫血清,以HRP酶标的羊抗兔IgG为二抗,测A450值。(2)间接免疫荧光:制备乙型脑炎病毒感染的BHK-21细胞抗原片,以1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600系列稀释的兔血清为一抗,FITC标记的羊抗兔血清为二抗,荧光显微镜下观察抗原片。 2 结 果 2.1 重组质粒的构建及鉴定(图 1)
以JEV病毒cDNA第一链为模板,扩增NS1基因,琼脂糖凝胶电泳显示在2 000~1 000 bp有条带,与目的基因大小1 245 bp相符。重组质粒pET30a-JEV NS1测序结果显示,NS1基因与NCBI公布的乙脑病毒SA14-14-2株(AF315119)的相应区段序列完全一致,同源性为100%。
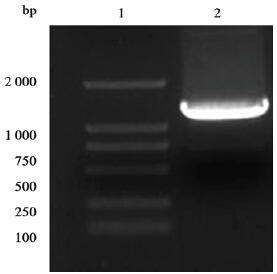 | 注:1.DNA分子量标记(DL2000);2.乙脑病毒NS1基因。 图 1 JEV NS1基因PCR扩增结果 |
NS1蛋白的预期分子量为47 kD,纯化后的重组蛋白经SDS-PAGE电泳分析结果表明蛋白的分子量与预期基本一致。Western bolt结果显示,重组抗原与乙脑病毒免疫的鼠多克隆腹水反应,在相应分子量位置出现条带,与正常鼠腹水不反应。
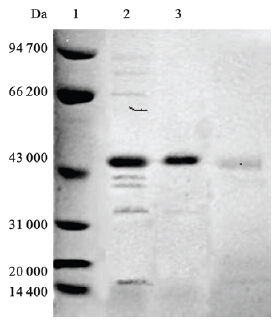 | 注:1为蛋白分子量标记;2和3为乙脑NS1蛋白。 图 2 Ni+亲和层析纯化JEV NS1重组蛋白SDS-PAGE结果 |
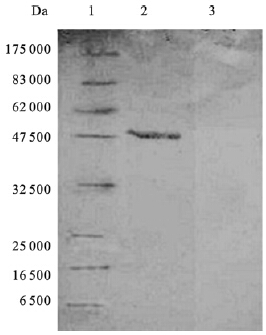 | 注:1:蛋白分子量标记;2:乙脑NS1蛋白;3:阴性对照。 图 3 JEV NS1蛋白Western Bolt分析结果 |
以纯化后的重组蛋白100 ng/孔包板,末次免疫后血清的效价达 NS1免疫兔血清抗体效价结果到1∶51 200以上。以免疫前血清为阴性对照,则免疫后2周血清与末次免疫后血清A450的P/N值见图 4,表明随着免疫时间的增加,抗体效价在逐渐升高。间接免疫荧光检测结果显示,将末次免疫后多抗血清作1∶50、1∶100、1∶200稀释时,JEV感染的BHK细胞均显示荧光,荧光强度为依次为:“++++”、“+++”、“+”。
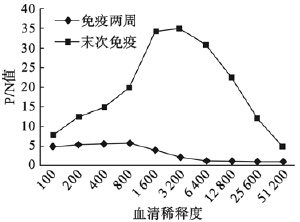 | 图 4 ELISA检测JEV NS1免疫兔血清抗体效价结果 |
黄病毒NS1蛋白是一种分泌型糖基化蛋白,在黄病毒科中高度保守。病毒感染哺乳动物细胞时,NS1蛋白主要以3种方式存在[5, 6]:(1)与细胞内的细胞器相连;(2)通过选择性运输途径分泌到细胞表面;(3)以可溶性的糖基化方式释放到细胞上清中。NS1蛋白在病毒的感染与免疫机制中的作用尚不清楚,采用基因工程技术表达NS1蛋白对于深入研究其功能及用途具有重要意义。
本研究采用原核表达系统表达 JEV NS1蛋白,获得了与预期分子量一致的JEV NS1蛋白,经weston blot检测、间接ELISA及间接免疫荧光检测均证实获得的NS1蛋白具有免疫原性。原核表达系统的优点是可产生大量蛋白,基因导入简单,成本较低。但其也存在一些难以克服的缺点,如有些基因的持续表达可能会对宿主细胞产生毒害作用;目的蛋白常以包涵体形式表达,导致产物纯化困难;翻译后加工修饰体系不完善。本研究发现,JEV NS1蛋白的表达量不大,纯化工作也较困难,多次实验均发现在梯度透析复性过程中会有较多的蛋白变性沉淀,导致复性蛋白的得率较低,尝试使用不同的复性体系和复性方法,未能得到理想结果。进一步工作中,可通过优化密码子,寻找合适的复性方法、采用真核表达系统等尝试提高JEV NS1蛋白的表达量。
| [1] | 唐晓燕,李幸乐,康锴,等.河南省部分地区病毒性脑炎监测分析[J].中国公共卫生,2012,28(7):967-970. |
| [2] | 张少白,李艺星,杨俊峰,等.陕西省2005年病毒性脑炎监测结果分析[J].中国公共卫生,2007,23(9):1114-1116. |
| [3] | Shu PY,Chen LK,Chang SF,et al.Dengue virus serotyping based on envelope and membrane and nonstructural protein NS1 serotype-specific capture immunoglobulin M enzyme-linked immunosorbent assays[J].Microbiol,2004,42:2489-2494. |
| [4] | Costa SM,Freire MS,Alves AMB.DNA vaccine against the non-structural 1 protein(NS1) of dengue 2 virus[J].Vaccine,2005,JAVC:5570-7773. |
| [5] | Walter E,Robert D,Philip K.Dengue virions and antigen in brain and serum of infected mice[J].Virol,1970a,6:500-506. |
| [6] | Mackenzie JM,Jones MK,Young PR.Immunolocalization of the dengue virus nonstructural glycoprotein NS1 suggests a role in viral RNA replication[J].Virology,1996,220:232-240. |
 2014, Vol. 30
2014, Vol. 30


