2. 中国医科大学第一临床学院临床药理教研室
锰(manganese,Mn)作为人体必需微量元素之一,对身体正常生长发育起重要作用,在体内参与多种生物代谢过程。但过量锰可以通过血脑屏障在脑内基底神经节蓄积,导致锰中毒。黑质是中脑的一个神经核团,黑质细胞富含黑色素,是脑内合成多巴胺的主要途径。在正常生理状态下,黑质是调节运动的重要中枢。研究证实,黑质是锰中毒氧化损伤的靶部位,尽管对锰致黑质损伤诱发神经毒性的机制尚未定论,近年来氧化应激已成为普遍认同的一种观点[1]。核转录因子NF-E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是抗氧化系统中重要的转录因子,生理状态下,它与胞浆蛋白伴侣分子Keap1 (Kelch-like ECH-associated protein 1)结合使活性处于相对抑制状态[2]。当暴露于氧化应激原下,Nrf2摆脱Keap1介导的抑制作用,进入细胞核,与抗氧化反应原件(antioxidant response element,ARE)结合,激活一系列下游抗氧化酶和Ⅱ相解毒酶表达,如血红素氧化酶-1(heme oxygenase-1,HO-1)和醌氧化还原酶1[NAD(P)H dehydrogenase quinone 1,NQO1]。这些酶对解毒体内有害物质,维持氧化还原平衡和细胞的存活有着重要作用[3, 4]。本研究拟通过体内实验观察不同剂量的氯化锰对小鼠脑黑质内细胞活性氧簇(reactive oxygen species,ROS)水平、Nrf2、Keap1、HO-1和NQO1表达影响,探讨锰所致的神经毒性机制,结果报告如下。 1 材料与方法 1.1 主要试剂与仪器
氯化锰(分析纯)、2,7-二氯荧光素二脂(2,7-dichlorofluorescin-diacetate,DCFH-DA)(美国Sigma-Aldrich公司),Nrf2、HO-1和NQO1兔抗原多克隆抗体(美国Santa Cruz公司),Keap 1兔抗原多克隆抗体、兔抗山羊链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)检测试剂盒、二氨基联苯胺试剂盒(武汉博士德生物工程有限公司)。FACSCAN流式细胞仪(美国Becton Dickison公司)。 1.2 动物分组与处理
昆明小鼠(中国医科大学实验动物中心)48只,体重(30±2)g,雌雄各半,许可证号:SCXK(辽)2008-0005。正式实验前适应性饲养1周,将小鼠按体重随机分为4组,每组12只,分别为对照组、低、中、高剂量染锰组。低、中、高剂量染锰组小鼠腹腔注射分别给予12.5、25、50 mg/kg MnCl2,对照组给予等量生理盐水,注射容量均为5 mL/kg,每天染毒1次,持续2周。末次染毒后24 h,每组随机取8只小鼠水合氯醛麻醉,心脏放血处死,迅速开颅取出完整大脑,冰浴下,切取黑质。其中每组4只小鼠黑质制备成单细胞悬液测定细胞内ROS;另外4只小鼠黑质用于Western blot法检测蛋白水平;剩余4只小鼠麻醉后,4%多聚甲醛经左心室灌流,免疫组化法检测Nrf2、Keap1、HO-1和NQO1表达。 1.3 指标与方法 1.3.1 ROS含量测定
小鼠脑黑质参照Villalba等[5]方法制备成单细胞悬液,用于流式细胞仪DCFH-DA染色法测定细胞内ROS。 1.3.2 免疫组化法检测Nrf2信号通路表达
小鼠麻醉灌流后,取黑质,4%多聚甲醛固定24 h,石蜡包埋后切片,按SABC检测试剂盒操作,一抗Nrf2、Keap1、HO-1和NQO1兔抗原多克隆抗体1∶100稀释,二抗为羊抗兔抗体按1∶100稀释,二氨基联苯胺显色,阳性结果为棕黄色,用自动曝光正置显微照相系统照像,采用MetamorphPDP10PBX51 彩色病理图文分析系统进行图像分析,每只动物取4张切片,每张切片分别采集3个视野,测定Nrf2、Keap1、HO-1和NQO1阳性细胞的积分光密度(IOD)。 1.3.3 Western blot检测Nrf2信号通路蛋白表达
黑质组织在冰上剪碎,应用蛋白变性裂解液提取蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转移到聚偏二氟乙烯膜上,一抗兔抗体Nrf2、Keap1、HO-1和NQO1按照1∶1000、1∶200、1∶1000和1∶500稀释,一抗小鼠抗体β-actin按照1∶500稀释,4 ℃封闭过夜, 含有tween-20的Tris盐酸缓冲液洗膜,二抗按照1∶5 000稀释,室温孵育2 h,加底物化学发光液发光,暗室显影1~5 min。计算目的蛋白灰度值与β-actin蛋白灰度值的比值,作为目的蛋白的相对表达量。 1.4 统计分析
实验数据以x±s表示,采用SPSS 13.0软件进行统计分析,采用单因素方差分析(ANOVA)进行组间比较,两组间比较用Q检验(Students-Newman-Keuls,SNK),以P<0.05为差异有统计学意义。 2 结 果 2.1 锰对小鼠脑黑质细胞内ROS水平影响
对照组、低、中、高剂量染锰组小鼠脑黑质细胞中ROS水平(平均荧光强度)分别为171.27、242.87、342.07和455.71;与对照组比较,染锰组小鼠脑黑质细胞内ROS含量明显升高,差异有统计学意义(P<0.05);随着MnCl2剂量增加,细胞内ROS水平逐渐增强,并呈剂量效应关系。 2.2 锰对小鼠脑黑质Nrf2信号通路免疫组化表达影响(表 1)
与对照组比较,各剂量染锰组小鼠脑黑质Nrf2表达均明显增加,差异有统计学意义(P<0.05)。与对照组比较,低剂量染锰组小鼠脑黑质Keap1表达降低、HO-1和NQO1表达升高(P<0.05),而高剂量染锰组小鼠脑黑质Keap1升高,NQO1表达明显降低(P<0.01)。
| 表 1 锰对小鼠黑质Nrf2信号通路免疫组化表达影响(IOD,x±s,n=4) |
与对照组比较,低剂量染锰组小鼠脑黑质Nrf2表达水平明显升高,差异有统计学意义(P<0.05);与对照组比较,低剂量染锰组小鼠脑黑质Keap1表达明显降低(P<0.01),HO-1、NQO1表达升高(P<0.05),高剂量染锰组小鼠脑黑质Keap1表达明显升高、NQO1表达明显降低(P<0.05)。
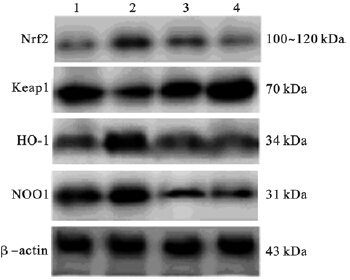 | 注:1:对照组;2~4:12.5、25.0、50.0 mg/kg染锰组 图 1 锰对小鼠脑黑质Nrf2信号通路蛋白表达影响(Western blot) |
| 表 2 锰对小鼠脑黑质Nrf2、Keap1、HO-1和NQO1蛋白表达水平影响(x±s,n=4) |
Nrf2通路具有激活调控解毒酶和抗氧化酶作用,近年来引起了国内外学者广泛关注。黑质可合成神经递质多巴胺,受刺激后会引发帕金森病及类似症状。研究证实氧化应激是导致锰中毒的主要机制,Benedetto等[6]发现当暴露于高浓度锰情况下,大脑中特定区域如黑质、苍白球和纹状体会发生氧化损伤,增加ROS水平和脂质过氧化等。本研究结果显示,暴露于不同浓度氯化锰后,小鼠脑黑质细胞内ROS水平明显增加并呈剂量效应关系,证实锰能通过血脑屏障并蓄积在黑质中,并导致机体氧化损伤。Nrf2信号通路为研究氧化应激的重要通路,Li等[7]在研究中发现,暴露于氯化锰之后大鼠肾上腺嗜络细胞瘤细胞核中的Nrf2表达增加,而且证实Nrf2通路的激活与ROS产生有关。本研究结果表明,低剂量染锰组小鼠脑黑质Nrf2表达明显增加,中、高剂量染锰组小鼠脑黑质Nrf2表达则逐渐降低,而Keap1表达变化正相反。这种反比可能是由于Nrf2和Keap1的特殊结构关系所致。HO-1和NQO1为受Nrf2/ARE 通路调节的最重要的抗氧化酶。本研究结果表明,低剂量染锰组小鼠脑黑质中HO-1和NQO1的表达显著增加,而中高剂量组则逐渐降低。与已有结果相似[8, 9, 10]。提示,锰神经毒性作用机制可能与锰致小鼠脑黑质细胞内的ROS水平升高,激活脑黑质Nrf2信号通路有关。
| [1] | Bowman AB, Kwakye GF, Herrero Hernández E, et al.Role of manganese in neurodegenerative diseases[J].Journal of Trace Elements in Medicine and Biology, 2011, 25(4):191-203. |
| [2] | 钟敏.Nrf2-Keap1抗氧化系统研究进展[J].中国公共卫生, 2006, 22(3):360-362. |
| [3] | Huang HC, Nguyen T, Pickett CB.Phosphorylation of Nrf2 at Ser-40 by protein kinase C regulates antioxidant response element-mediated transcription[J].Journal of Biological Chemistry, 2002, 277(45):42769-42774. |
| [4] | Zhang DD.Mechanistic studies of the Nrf2-Keap1 signaling pathway[J].Drug Metabolism Reviews, 2006, 38(4):769-789. |
| [5] | Villalba M, Martínez-Serrano A, Brner C, et al.NMDA-induced increase in[Ca2+]i and 45 Ca2+ uptake in acutely dissociated brain cells derived from adult rats[J].Brain Res, 1992, 570(1-2):347-353. |
| [6] | Benedetto A, Au C, Avila DS, et al.Extracellular dopamine potentiates Mn-induced oxidative stress, lifespan reduction, and dopaminergic neurodegeneration in a BLI-3-dependent manner in Caenorhabditis elegans[J].PLoS Genetics, 2010, 6(8):e1001084. |
| [7] | Li H, Wu S, Shi N, et al.NF-E2-related factor 2 activation in PC12 cells:its protective role in manganese-induced damage[J].Archives of Toxicology, 2011, 85(8):901-910. |
| [8] | Ueda K, Ueyama T, Yoshida K, et al.Adaptive HNE-Nrf2-HO-1 pathway against oxidative stress is associated with acute gastric mucosal lesions[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2008, 295(3):G460-G469. |
| [9] | Kurzatkowski DM, Trombetta LD.Maneb causes pro-oxidant effects in the hippocampus of Nrf2 knockout mice[J].Environmental Toxicology and Pharmacology, 2013, 36(2):427-436. |
| [10] | Casalino E, Calzaretti G, Landriscina M, et al.The Nrf2 transcription factor contributes to the induction of alpha-class GST isoenzymes in liver of acute cadmium or manganese intoxicated rats:comparison with the toxic effect on NAD (P)H:quinone reductase[J].Toxicology, 2007, 237(1):24-34. |
 2014, Vol. 30
2014, Vol. 30


