通过细菌的16S rRNA序列分析对细菌进行鉴定与分类是目前细菌鉴定最有效的方法之一,尤其适用于复杂疫情的快速筛查与检验[1]。但是,现有的16S rRNA扩增引物大多具有种属亲嗜性,在模板浓度较低时难以获得阳性扩增结果,在混合微生物感染等复杂状况时易出现嵌合序列产物或不均等扩增现象,影响其广泛应用。为此,本研究建立一种高效、灵敏、无偏倚地扩增主要细菌性病原体的16S rRNA序列方法,为细菌性病原体导致的重大疫情监测提供技术支持。 1 材料与方法 1.1 序列获取
对于《预防医学微生物学及检验技术》[2]中所涉及全部细菌性病原微生物种,经Eztaxon(www.eztaxon.org/)链接的美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网址下载国际公认标准株16S rRNA序列,并在The Taxonomic Outline of Bacteria and Archaea(http://www.taxonomicoutline.org)中下载对应序列,序列比对无误后进行分析。 1.2 引物设计
将上述验证后序列经cluxtalX比对,在Mega5下运行、截取相同长度序列后再次比对分析,寻找高度保守区作为备选引物序列,最后经Primer 5和Oligo 6筛选引物序列。按上述方式分别确定内侧引物和外侧引物,并用Primer 5计算二者间兼容性。 1.3 引物验证
培养各细菌性病原微生物种标准株,提取核酸(EZ1 advanced,DNA extract kit,Cat#95304),10倍梯度稀释后采用上述设计的内外侧引物分别进行单重扩增,筛选全部扩增结果为阳性且检出限较低的引物对备用。聚合酶链反应(polymerase chain reaction,PCR)应体系为50 μL,含10 pmol/L上下游引物、1 u AmpliTaq聚合酶(Roche,Cat#3657),扩增条件为预变性95 ℃ 5 min,94 ℃ 30 s、56 ℃ 2 min、72 ℃ 1 min,35个循环,最后72 ℃延伸10 min。 1.4 引物加尾
采用Primer 5中multiplex/nested功能对内侧引物进行加尾,再采用加尾后内侧引物扩增标准株核酸的产物为模板,10倍稀释后验证加尾引物的扩增效率。选取扩增效率高者与外侧引物、内侧引物等比混合后再次PCR,验证三者间的兼容性,舍弃产生非特异扩增等异常反应的引物。PCR反应体系及条件同上。 1.5 Touch down-Templex PCR(TdT-PCR)检测复杂标本
经多次试验后,确定采用极低浓度的外侧引物、较高浓度的内侧引物和高浓度的加尾引物对目标序列进行扩增,三者浓度呈指数关系,PCR反应体系仍为50 μL,含1 u AmpliTaq聚合酶,扩增条件为:预热阶段,95 ℃ 5 min;富集阶段,94 ℃ 30 s,56 ℃ 2 min,72 ℃ 1 min,10个循环;引标阶段,94 ℃ 30 s,55 ℃-0.5 ℃/R 2 min,72 ℃ 1 min,10个循环;扩增阶段,94 ℃ 30 s,50 ℃ 1 min,72 ℃ 1 min,35个循环;延伸阶段,72 ℃ 10 min。 1.6 模拟标本检测及敏感度对比分析
采用肺炎链球菌、金黄色葡萄球菌、铜绿假单胞菌、小肠结肠炎耶尔森菌、甲型溶血性链球菌、乙型溶血性链球菌、大肠埃希菌、鲍氏志贺菌C群2型、福氏志贺菌B群1b型、痢疾志贺菌A群3型、伤寒沙门菌H901、甲型副伤寒沙门菌、水弧菌、副溶血弧菌、表皮葡萄球菌和大肠杆菌O157等标准株[2],将比浊度为0.3~0.5的标准菌株菌悬液10倍梯度稀释,混入健康人血液或痰标本中,制成模拟标本备用。提取模拟标本核酸,分别采用外侧引物按1.3条件进行单重PCR扩增、内外侧引物与加尾引物按1.5条件进行3重扩增,PCR 结果经1%琼脂糖电泳检测、测序鉴定后比较二者的敏感度。 2 结 果 2.1 序列获取(图 1)
经比对后,共获得57种符合条件的细菌性病原微生物种标准株16S rRNA序列。共设计合成引物37条,涵盖55个物种。梭杆菌科梭杆菌属和乳杆菌目明串珠菌科的标准菌株16S rRNA序列由于与其他物种的序列差异较大、检测价值不高而舍去
 | 图 1 部分细菌性病原微生物种标准株16S rRNA序列比对结果 |
共筛选出1对外侧引物、3条内侧引物,其中内侧上游引物为2条简并引物的等比混合物。共设计加尾引物3对,与待检细菌的16S rRNA序列均无非特异扩增,选取其中扩增效率最高者进行后续实验。 2.3 TdT-PCR检测复杂标本的敏感性分析(图 2)
分别采用单纯外侧引物扩增(单重PCR)和TdT-PCR方法对模拟标本进行检测,经测序验证的电泳结果显示,2方法均可对上述标本进行有效扩增,而TdT-PCR的敏感性均较单纯外侧引物扩增法高10~100倍(图 2仅为金黄色葡萄球菌模拟标本的扩增结果)。
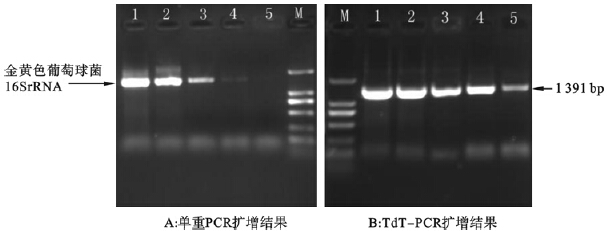 | 注:M:DL2000 Marker,1~5:为1:10-1~1:10-5稀释的金黄色葡萄球菌模拟标本。 图 2 单重PCR和TdT-PCR扩增金黄色葡萄球菌模拟复杂标本分析 |
由于16S rRNA分析鉴定技术无需分离培养,可快速鉴定已有病原微生物、发现新病原等,具有传统细菌性病原微生物鉴定技术无可比拟的优势[3, 4],日益受到关注。但是,现有的16S rRNA扩增引物大多具有种属亲嗜性且偏重于环境微生物检测,在低目标模板浓度时难以有效扩增且易产生嵌合序列,难以满足突发公共卫生事件等复杂疫情处理的需要,影响其实际应用[5]。
本研究将《预防医学微生物学及检验技术》中所涉及的所有细菌性病原微生物种标准株16S rRNA序列纳入分析,在仅舍弃其中2株的情况下设计筛选出高效的巢式扩增引物和加尾引物,又从引物浓度和扩增方法等多方面加以优化,与常规方法比较,扩增效率提高10~100倍。而且低浓度的外侧引物在保障富集反应特异性同时减低了反应过程中的背景值、巢式PCR提高了引物间的相容性、通用的加尾引物使目标模板更容易扩增;而Touch down PCR和Templex PCR有机结合,可高效、灵敏、无偏倚地从待测样本中获取rRNA序列。如果在此基础上对扩增子进行二代的单分子测序和序列分析,可在1次反应中同时筛查与检测预防医学相关的主要细菌性病原体。
| [1] | Busse HJ,Denner EB,Lubitz W.Classification and identification of bacteria:current approaches to an old problem.Overview of methods used in bacterial systematics[J].J Biotechnol,1996,47(1):3-38. |
| [2] | 王秀茹.预防医学技术[M].北京:人民卫生出版社,2009:416-427. |
| [3] | 张锦海,陈文琦,朱进,等.烈性呼吸道细菌多重荧光PCR检测方法建立[J].中国公共卫生,2011,27(10):1237-1239. |
| [4] | 张捷,王佩荣,张惠媛,等.食源性致病菌分子马达检测技术研究进展[J].中国公共卫生,2011,27(10):1252-1254. |
| [5] | 周煜.16S rRNA序列分析法在医学微生物鉴定中的应用[J].生物技术通讯,1999,10(4):287-305. |
 2013, Vol. 29
2013, Vol. 29


