2. 郑州大学公共卫生学院流行病学教研室;
3. 郑州大学基础医学院寄生虫学教研室
乳酸乳球菌(Lactococcus lactis,L.lactis)是一种革兰阳性食品级细菌,通常被认为是安全的,已经在乳制品发酵工业方面应用多年。原核表达系统(nisin-controlled expression,NICE)是目前最有效的食品级诱导表达系统,以乳酸链球菌素(nisin)作为诱导信号,已成功应用于多种菌株,包括乳球菌、乳杆菌、链球菌和肠球菌等[1 -2]。幽门螺杆菌(Helicobacter pylori,Hp)的热休克蛋白(heat shock protein,Hsp)在Hp对胃黏膜上皮的粘附、尿素酶亚单位的运输与尿素酶复合物的装配以及刺激机体产生免疫应答等方面起着重要作用,是Hp的主要免疫原之一。热休克蛋白A(HspA)是Hsp的主要功能单位,具有免疫原性且位于细菌表面,相对保守,是Hp疫苗抗原的重要候选组分之一。为探索Hp的口服乳酸菌疫苗,本研究利用NICE表达系统构建乳酸乳球菌重组子NZ3900/pNZ8110-hspA,探讨HpHspA在乳酸菌中的表达及其对细菌生长的影响,并对其免疫反应性进行鉴定,结果报告如下。 1 材料与方法 1.1 菌株与质粒
幽门螺杆菌河南分离株(MEL-Hp27)分离自河南省慢性浅表性萎缩性胃炎患者;乳酸乳球菌NZ3900和表达质粒pNZ8110(荷兰NIZO食品研究所);大肠杆菌MC1061(中国医学科学院流行病学微生物研究所阚彪博士惠赠)。 1.2 主要仪器与试剂
台式高速冷冻离心机(德国Heraeus公司),Gene Genius凝胶图像分析仪(美国syngene公司),CO2培养箱(德国GmbH公司),Powerlook扫描仪(台湾Umax公司);M17培养基(美国Difco公司),限制性内切酶(大连TaKaRa有限公司),凝胶回收试剂盒(杭州Axygen生物技术有限公司),氯霉素、溶菌酶(美国Amresco公司),Nisin(美国Sigma公司);GM17液体培养基(添加葡萄糖的M17液体培养基)配制:称取3.73 g M17培养基,溶于80 mL蒸馏水中,调pH值至7.2,定容至100 mL,高压灭菌,冷却后加入无菌滤膜过滤的葡萄糖至终浓度0.5%(W/V)。 1.3 指标与方法 1.3.1 幽门螺杆菌hspA基因扩增和测序
利用生物软件Primer 5.0设计幽门螺杆菌hspA的PCR引物,上游引物5′端引入Nco I限制性酶切位点,同时添加碱基以保证读码框不变;下游引物5′端引入Xba I限制性酶切位点。引物序列如下:上游引物5′-catgccatgggcatgaagtttctacca-3′,下游引物5′-cggtctagattagtgttttttgtgatc-3′;产物长度363 bp,引物由北京赛百盛公司合成。以幽门螺杆菌MEL-Hp27的基因组为模板PCR扩增hspA,循环条件为:95 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。PCR产物测序由北京博尚有限公司完成。 1.3.2 大肠杆菌重组子MC1061/pNZ8110-hspA构建
将经过Xba I和Hind III双酶切的hspA基因片段与经同样双酶切的pNZ8110表达质粒进行过夜连接,连接产物用氯化钙法转化感受态大肠杆菌MC1061,构建MC1061/pNZ8110-hspA重组子。采用菌液PCR和质粒双酶切鉴定MC1061/pNZ8110-hspA重组子。 1.3.3 乳酸乳球菌重组子NZ3900/pNZ8110-hspA构建及鉴定
参照文献[3],制备乳酸乳球菌感受态NZ3900。将40 μL 感受态NZ3900与4 μL pNZ8110-hspA质粒转入预冷的2 mm电击杯,2.0 kV、25 μF、200 Ω进行电击转化后,迅速加入800 μL GM17恢复培养基,30 ℃恢复培养2 h,取150 μL培养物接种于含10 μg/mL氯霉素的GM17固体培养基,待菌液吸收完全后倒置平板,30 ℃培养约40 h。挑取单菌落接种于含10 μg/mL氯霉素的GM17液体培养基,30 ℃静置过夜。采用菌液PCR和质粒双酶切鉴定NZ3900/pNZ8110-hspA重组子。 1.3.4 hspA对重组乳酸乳球重组子生长影响
分别将NZ3900、NZ3900/pNZ8110和NZ3900/pNZ8110-hspA活化种子液以1∶25(v/v)转种于10 mL GM17液体培养基,30 ℃静置培养,每间隔1 h混匀各试管菌液测定吸光度(A600)值,以培养时间为横坐标,A600值为纵坐标绘制NZ3900、NZ3900/pNZ8110、NZ3900/pNZ8110-hspA菌株生长曲线。 1.3.5 Nisin浓度对乳酸乳球重组子生长影响
将NZ3900/pNZ8110-hspA活化种子液以1:25(v/v)转种于7只加入10 mL GM17液体培养基试管中,分别加入Nisin储存液至终浓度为0、10、20、40、60、80和100 ng/mL,30 ℃静置培养,每间隔1 h混匀各试管菌液测定A600值,以培养时间为横坐标,A600值为纵坐标绘制生长曲线,观察不同浓度Nisin对NZ3900/pNZ8110-hspA菌株生长影响,同时以NZ3900、NZ3900/pNZ8110作为对照。 1.3.6 HspA在乳酸乳球菌中的诱导表达
取过夜培养NZ3900/pNZ8110-hspA 400 μL转种于10 mL含10 μg/mL氯霉素的GM17液体培养基,30 ℃静置培养4 h后,加入Nisin储存液至终浓度为10和20 ng/mL,分别进行诱导表达,4 h后收集菌体进行超声破碎,收集上清蛋白,Bradford法定量后,每孔上样50 μg总蛋白,分别采用钠十二烷基硫酸盐-聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和Tricine SDS-PAGE检测HspA蛋白在乳酸乳球菌中表达。 1.3.7 乳酸乳球菌重组子表达的HspA蛋白免疫反应性检测
经诱导表达HspA蛋白的乳酸乳球菌重组子超声破碎后取上清进行15% SDS-PAGE凝胶电泳,用Bio-Rad半干式电转印仪转膜,电压15 V,电转10 min。封闭后将硝酸纤维素膜置于用封闭液1:100稀释的小鼠抗Hp血清中,37 ℃轻摇孵育1~2 h。磷酸盐缓冲液和Tris-HCl缓冲液各洗3次后将膜置于用含5% (W/V)脱脂奶粉的Tris-HCl缓冲液稀释的第二抗体中,37 ℃作用1~2 h,Tris-HCl缓冲液洗3次,每次10 min。然后将膜放入平皿中,加入1 mL新鲜配置的增强型辣根过氧化物酶标记的二氨基联苯胺显色液,轻轻振摇,直至显色充分,用去离水漂洗,终止显色,将膜转入磷酸盐缓冲液中,照相保存。 2 结 果 2.1 hspA基因扩增和测序结果(图 1)
以MEL-Hp27基因组为模板PCR扩增hspA后,扩增产物行琼脂糖凝胶电泳,结果显示扩增片段长度为363 bp,与预期结果一致。测序结果进一步证实成功扩增了hspA基因。
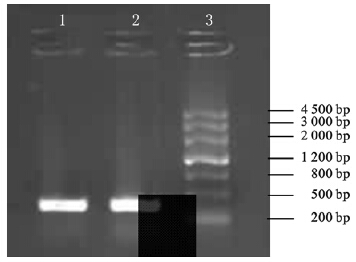 | 注:1、2:hspA基因PCR扩增产物;3:DNA marker。 图 1 hspA基因PCR扩增产物 |
菌液PCR扩增结果凝胶电泳显示,以MC1061/pNZ8110-hspA重组子为模板成功扩增到363 bp目的基因片断,XbaⅠ单酶切和NcoⅠ、XbaⅠ双酶切产物片断长度均与预期目的片断一致。
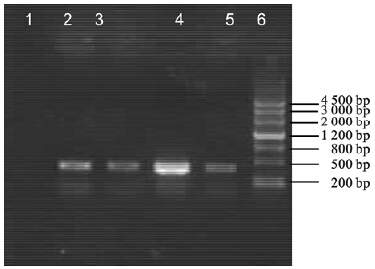 | 注:1:阴性对照;2~5:MC1061/pHZ28110-hspA菌液PCR产物;6:DNA maker。 图 2 MC1603/pHZ8110-hspA菌液PCR鉴定 |
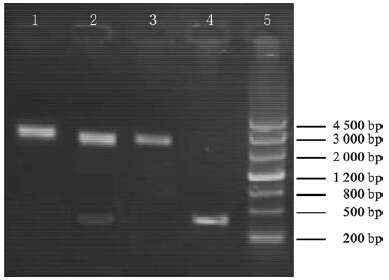 | 注:1:Xba I酶切产物;2:Nco I和Xba I双酶切产物;3:Xba I酶切产物;4:hspA基因PCR产物;5:DNA maker。 图 3 pHZ8110-hspA重组质粒酶切鉴定 |
将NZ3900、NZ3900/pNZ8110、NZ3900/pNZ8110-hspA活化种子液分别转种后,前2 h内细菌生长较为缓慢,随后细菌进入对数生长期,约8 h后细菌生长进入平台期,吸光度A600值达2.0左右。虽然NZ3900/pNZ8110和NZ3900/pNZ8110-hspA菌株在对数生长期内,生长速度较空菌NZ3900缓慢,但进入平台期后细菌浓度与空菌比较无明显差异,提示hspA基因的插入并未对菌株生长造成影响。
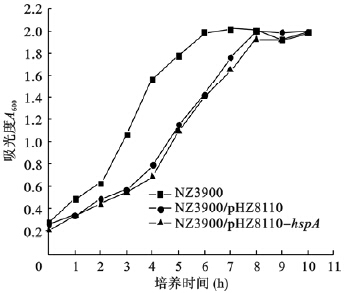 | 图 4 NZ3900、NZ3900/pNZ8100和NZ3900/pNZ8110-hspA菌株生长曲线 |
不同浓度Nisin对乳酸乳球菌重组子NZ3900/pNZ8110-hspA生长均有抑制作用,随着Nisin浓度增加,NZ3900/pNZ8110-hspA菌生长速度明显减缓,经过21 h培养后,未加Nisin组NZ3900/pNZ8110-hspA菌株A600为1.989,而100 ng/mL Nisin组NZ3900/pNZ8110-hspA菌株A600仅为1.125。空白对照及阴性对照生长曲线结果显示不同浓度Nisin对NZ3900和NZ3900/pNZ8110生长无明显影响。
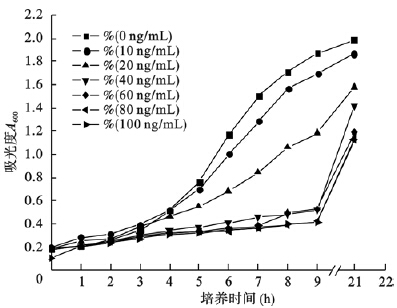 | 图 5 Nisin浓度对NZ3900/pNZ8100-hspA影响 |
分别经10、20 ng/mL Nisin诱导后,NZ3900/pNZ8110-hspA重组子在预期目的蛋白分子量条带处均未观察到相应条带,表明无目的蛋白表达或表达量较低不能在SDS-PAGE和Tricine SDS-PAGE凝胶电泳图上观察到。空白对照NZ3900和阴性对照NZ3900/pNZ8110均未观察到相应蛋白条带。 2.6 乳酸乳球菌重组子表达HspA蛋白的免疫反应性检测
Western-blot结果显示,诱导表达重组子各孔均出现预期蛋白分子量大小13.192 kD条带,而空白对照NZ3900和阴性对照NZ3900/pNZ8110均无相应条带。 3 讨 论
Hp是流行最广泛的人类病原体,全世界约有50%人口感染,因此研制Hp疫苗具有重要意义。近年来,由于基因可获得性和易操作性,乳酸乳球菌作为活菌疫苗载体已成功表达了多种外源基因,成为应用最为广泛的基因表达革兰阳性宿主菌[4, 5, 6]。有研究报道,翻译融合表达载体较转录融合表达具有更高的表达活性。为尽可能得到较大量目的蛋白,本研究设计构建Hp hspA基因的翻译融合表达系统,将hspA基因插入pNZ8110质粒启动子nisA的核糖体结合位点下游,利用启动子nisA上NcoⅠ酶切位点的ATG起始密码子作为翻译起始密码子,成功构建了hspA抗原基因在乳酸乳球菌NZ3900菌株中的翻译融合表达系统。本研究结果表明,hspA的插入未对乳酸乳球菌重组菌的生长产生影响,进入平台期后空菌和重组子可以达到相同的细菌密度;不同浓度Nisin对NZ3900和NZ3900/pNZ8110菌株生长无明显影响,除10 ng/mL Nisin对重组菌生长影响较小外,其余各浓度Nisin对重组子的生长均有明显抑制;SDS-PAGE检测未观察到HspA条带;western-blot鉴定结果显示,乳酸乳球菌表达的HspA抗原蛋白具有良好的免疫反应性。推测可能并非Nisin作为抑菌素本身抑制细菌生长,而是Nisin作为诱导剂在加入10 ng/mL时未能有效诱导HspA表达,但在加入较高浓度Nisin后少量外源热休克蛋白的表达即对重组子的生长产生了抑制作用。本研究构建的HspA乳酸菌表达系统及免疫反应性鉴定为进一步免疫预防Hp的感染提供了研究基础。
| [1] | Pavan S,Hols P,Delcour J,et al.Adaptation of the nisin-controlled expression system in Lactobacillus plantarum:a tool to study in vivo biological effects[J].Applied and Environmental Microbiology,2000,66(10):4427. |
| [2] | Bryan EM,Bae T,Kleerebezem M,et al.Improved vectors for nisin-controlled expression in gram-positive bacteria[J].Plasmid,2000,44(2):183-190. |
| [3] | 张小娟,张荣光,段广才,等.乳酸乳球菌NZ3900电转化条件的优化[J].山东医药,2010,50(11):53-55. |
| [4] | Pei H,Liu J,Cheng Y,et al.Expression of SARS-coronavirus nucleocapsid protein in Escherichia coli and Lactococcus lactis for serodiagnosis and mucosal vaccination[J].Appl Microbiol Biotechnol,2005,68(2):220-227. |
| [5] | Robinson K,Chamberlain LM,Lopez MC,et al.Mucosal and cellular immune responses elicited by recombinant Lactococcus lactis strains expressing tetanus toxin fragment C[J].Infect Immun,2004,72(5):2753-2761. |
| [6] | Mierau I,Olieman K,Mond J,et al.Optimization of the Lactococcus lactis nisin-controlled gene expression system NICE for industrial applications[J].Microbial Cell Factories,2005,4(1):16. |
 2013, Vol. 29
2013, Vol. 29
