基酚是一种环境内分泌干扰物,具有一定的胚胎毒性和致畸性[1]。已报道测定辛基酚的方法有高效液相色谱[2]、液质联用[3]、气质联用法[4]等。电化学方法具有操作简单、响应快、灵敏度高的优点,碳纳米管在电分析化学领域中已有广泛应用;将其酸化处理,能对某些物质产生特有的吸附或催化效应[5, 6]。本研究为建立一种检测辛基酚的电化学方法,构建羧基化碳纳米管(carboxylated carbon nanotube,c-CNT)修饰电极,探讨辛基酚在该修饰电极上的电化学行为,并用示差脉冲伏安法对其进行测定。
1 材料与方法 1.1 主要仪器与试剂CHI 660C电化学工作站(美国CHI公司);电化学池采用三电极系统:修饰玻碳电极(glassy carbon,GC,直径4mm)为工作电极,饱和甘汞电极为参比电极,铂电极为对电极。辛基酚、壳聚糖(chitosan,CS)和碳纳米管(CNT)(美国Sigma公司),使用时未经纯化;不同pH值的0.1mol/L的磷酸盐缓冲溶液(phosphate buffer solution,PBS);0.1mol/L的HAc-NaAc缓冲溶液;B-R缓冲溶液(0.04mol/L混酸和0.2mol/LNaOH);其他化学试剂均为分析纯,实验用水均为石英亚沸水。
1.2 碳纳米管羧基化将3.0gCNT分散于150mL浓硝酸中,超声分散30min,然后在120℃下对混合液进行不断搅拌回流5h,冷却至40℃,过滤。将得到的c-CNT用去离子水洗至滤液的pH值呈中性,在60℃下真空干燥12h备用。
1.3 电极修饰玻碳电极分别用粗砂纸和细砂纸抛光,然后用麂皮将其抛光成镜面,用石英亚沸水冲洗干净。将清洁干净的玻碳电极放入1.5mg/mL壳聚糖溶液中,于-2.0V下电沉积5min,即得壳聚糖修饰玻碳电极,用石英亚沸水冲洗后于室温下干燥,电沉积在玻碳电极表面的壳聚糖带正电。再将壳聚糖修饰的玻碳电极浸泡到0.5mg/mLc-CNT溶液中30min,由于c-CNT表面带负电,通过静电自组装即得c-CNT-CS/GC电极。
1.4 实验方法(1)修饰电极的表征:电化学交流阻抗(electrochemical impedance spectroscopy,EIS)谱图中半圆的直径等同于电子探针的电子转移阻抗(electron transfer resistance,Ret),其大小决定了氧化还原探针在电极表面的电子转移动力学[7]。EIS实验在含有1.0mmol/LK3Fe(CN)6/K4Fe(CN)6(1∶1)混合物的0.1mol/LKCl溶液中进行,频率范围为10-2~104Hz,开路电位为170mV。循环伏安实验表征是将电极置于5.0mmol/LK3Fe(CN)6溶液中进行循环伏安扫描,扫描速度为100mV/s。(2)辛基酚在修饰电极上的电化学行为:以0.10mol/LpH6.0的PBS作为支持电解质。在加入辛基酚后,采用循环伏安法[8]对修饰电极进行扫描。实验前所有溶液均通入高纯氮气除氧30min,并维持在氮气氛围中。实验在(25±0.2)℃条件下进行。(3)辛基酚在修饰电极上测定条件优化:用循环伏安法探讨不同电解质溶液对辛基酚测定的影响。分别在3.0mL0.1mol/L的PBS、HAc-NaAc、B-R缓冲溶液中加入2.5×10-6mol/L的辛基酚,用循环伏安法扫描。选择最佳电解质溶液后,考察电解质的pH值对辛基酚测定影响。在含有2.5×10-6mol/L辛基酚,pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0的PBS中进行循环伏安扫描,记录辛基酚的峰电位及峰电流。(4)工作曲线:选择最佳的实验条件,采用示差脉冲伏安法[9, 10]用修饰电极测定不同浓度的辛基酚,记录氧化峰电流,得到测定辛基酚的工作曲线。实验重复3次。(5)修饰电极重现性及稳定性:采用同一支修饰电极对3.0×10-6mol/L的辛基酚平行测定10次,计算相对标准偏差。将修饰电极放置2d后再次测定相同浓度的辛基酚,与2d前测定的峰电流比较,考察修饰电极的稳定性。(6)干扰实验:用示差脉冲伏安法(支持电解质:pH6.0PBS;扫描速度:100mV/s)对1.0×10-6mol/L辛基酚进行测定,控制相对误差在±5%以内[6],考察其他离子及多巴胺、抗坏血酸、尿酸等对辛基酚测定的干扰。(7)回收实验:采用修饰电极,以pH6.0的PBS做支持电解质,扫描速度为100mV/s,用示差脉冲伏安法进行测定,分别移取3份2.0×10-6mol/L和4.0×10-6mol/L的辛基酚标准溶液5mL于电解杯中,分别加入一定量的标准样品储备液进行加标回收率实验。
2 结果 2.1 修饰电极的电化学交流阻抗和循环伏安表征实验结果表明,玻碳电极的Ret较小(约200Ω),当其表面沉积了壳聚糖膜时,Ret值变大(约1700Ω),表明壳聚糖膜阻碍了电子传递。再将壳聚糖修饰的玻碳电极浸泡到c-CNT中,半圆直径变小(约1100Ω),提示电极表面的c-CNT能加速电子传递。将电极置于5.0mmol/LK3Fe(CN)6溶液中进行循环伏安扫描也可以用来监测电极修饰过程中动力学参数变化。在玻碳电极上,K3Fe(CN)6有一对几乎可逆的氧化还原峰。当壳聚糖沉积到电极表面后,氧化还原峰电流减小,峰电位差增加,表明沉积的壳聚糖膜阻碍了探针的电子传递。再将c-CNT修饰到玻碳电极表面后,氧化还原峰电流明显增加,表明c-CNT能够加速电子在电极表面传递。与EIS表征结果一致,进一步证明c-CNT已经成功地组装到电极表面。
2.2 辛基酚在修饰电极上的电化学行为(图 1)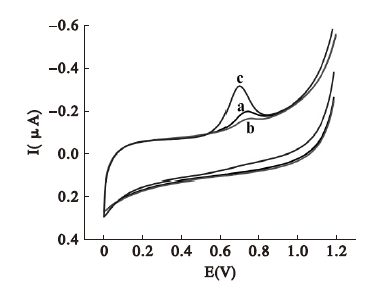 | 注: a: GC 电极; b: CS /GC 电极; c: c-CNT-CS /GC 电极。图 1 1.0 × 10-6 mol /L 辛基酚在不同电极上的循环伏安图( pH 6.0 的PBS中) |
在玻碳电极上,辛基酚有一不灵敏的氧化峰(曲线a)。而在c-CNT修饰电极上氧化峰电流明显增加,并且氧化电位降低(曲线c)。这是由于碳纳米管的大比表面积和强吸附能力,对辛基酚表现出高富集效率,使电子交换变得容易,因此对辛基酚有更加灵敏的响应。在50~300mV/s扫描速度范围内,辛基酚的氧化峰电流随扫描速度增加而增大,峰电位正移。当扫描速度>100mV/s时,背景电流变大。因此本研究中扫描速度选择为100mV/s。
2.3 支持电解质和pH值的影响实验比较了辛基酚在0.1mol/L的PBS、HAc-NaAc缓冲液、B-R缓冲液中的电化学行为,结果表明,在PBS中峰形最好,峰电流最大,故选择0.1mol/LPBS作为测定介质。配制一系列不同pH值的PBS缓冲溶液,用循环伏安法测辛基酚的峰电流与峰电位。结果表明:在pH从3.0~9.0的PBS中,随着pH增加,峰电位发生负移,提示有H+参加了反应。并且在pH值为6.0时,峰电流值最大。因此,本实验选择pH6.0的PBS做支持电解质。
2.4 工作曲线、重现性和稳定性在选定的实验条件下(支持电解质:pH6.0PBS;扫描速度:100mV/s),用示差脉冲伏安法考察在修饰电极上辛基酚浓度与氧化峰电流的关系。发现当浓度增加时,辛基酚的峰电流不断增加,且氧化峰电流与其浓度在8.33×10-8~2.0×10-5mol/L的范围内呈良好的线性关系。检测限为3.67×10-8mol/L(S/N=3)。采用同一支电极对3.0×10-6mol/L的辛基酚平行测定10次,相对标准偏差为3.6%,表明该修饰电极具有良好的重复性。将修饰电极放置2d后再次测定,峰电流为最初峰电流的95%,表明该修饰电极具有较高的稳定性。
2.5 干扰实验在选定的实验条件下对1.0×10-6mol/L辛基酚进行测定,允许相对误差在±0.5%时,结果表明,大部分离子如K+、Na+、NH4+、Ca2+、Mg2+、Cl-、NO3-、Ag+、Sr2+、Zn2+、Cd2+、Ni+、F-、Cl-、NO3-、SO42-和PO43-对测定无干扰;50倍量的多巴胺、抗坏血酸、尿酸几乎不干扰辛基酚测定;而10倍的双酚A和壬基酚对辛基酚测定有一定干扰。
2.6 回收实验对6个样品分别平行测定3次,回收率为(92.5±0.1)%~(106.5±0.1)%。
3 讨论传统的测定辛基酚的方法存在着诸如预处理繁琐、仪器设备昂贵、操作复杂等方面的不足[2, 3, 4]。本研究利用碳纳米管比表面积大、吸附性能强等特殊的性质,将羧基化的碳纳米管组装在电沉积壳聚糖的玻碳电极表面,构建c-CNT-CS/GC修饰电极,研究了辛基酚在该修饰电极上的电化学行为及其测定。电化学交流阻抗等实验结果表明,具有较大比表面积的羧基化碳纳米管已经通过自组装的方法成功组装到电极表面,组装的碳纳米管能够加速电子在电极表面传递。同时,与裸玻碳电极比较,构建的修饰电极能明显增强辛基酚在电极上的电化学响应。在优化的实验条件下,辛基酚的氧化峰电流与其浓度呈良好的线性关系,测定模拟样品中辛基酚的平均回收率结果满意。该方法测定辛基酚的灵敏度高,稳定性好,线性范围宽,结果准确可靠,为辛基酚的检测提供了一种简单、灵敏、干扰少的新的电化学方法,对探索环境中痕量雌激素测定的新方法具有实际意义。构建的电化学传感器将在生物科学、环境监测等领域具有较好的应用前景。
| [1] | Jobling S,Casey D,Rodgers-Gray T,et al.Comparative responses ofmolluscs and fish to environmental estrogens and an estrogenic ef-fluent[J].Aquatic Toxicology,2003,65:205-220. |
| [2] | Zhao RS,Wang X,Yuan JP,et al.Solid-phase extraction of bisphe-nol A,nonylphenol and 4-octylphenol from environmental watersamples using microporous bamboo charcoal,and their determina-tion by HPLC[J].Microchimica Acta,2009,165:443-447. |
| [3] | 胡小键,张海婧,林少彬.水中烷基酚及烷基苯氧基羧酸LC/MS/MS测定[J].中国公共卫生,2011,27(3):356-357. |
| [4] | Kawaguchi M,Ito R,Sakui N,et al.Stir-bar-sorptive extraction,with in-situ deconjugation,and thermal desorption with in-tube si-lylation,followed by gas chromatography-mass spectrometry formeasurement of urinary 4-nonylphenol and 4-tert-octylphenol glu-curonides[J].Analytical and Bioanalytical Chemistry,2007,388:391-398. |
| [5] | 明亮,习霞,刘杰.水中酚类物质碳纳米管酪氨酸酶传感器测定[J].中国公共卫生,2009,25(11):1304-1305. |
| [6] | 李俊华,邝代治,冯泳兰,等.基于羧基化碳纳米管修饰电极伏安法同时测定痕量铟和铝[J].分析化学,2011,39(5):713-717. |
| [7] | Gu HY,Yu AM,Chen HY.Direct electron transfer and character-ization of hemoglobin immobilized on a Au colloid-cysteamine-modified gold electrode[J].Journal of Electroanalytical Chemis-try,2001,516:119-126. |
| [8] | 张艳,何晓英,李容,等.安乃近在蒙脱土修饰电极上的电化学行为及测定[J].分析科学学报,2010,26(1):75-78. |
| [9] | 金根娣,胡效亚.应用锑膜修饰电极示差脉冲伏安法同时测定多巴胺和抗坏血酸[J].理化检验:化学分册,2008,44(11):1042-1046. |
| [10] | 姚开安,王娜,赵斌程,等.示差脉冲伏安法测定乳酸脱氢酶活性及纳米微粒生物毒性检测新方法研究[J].无机化学学报,2007,23(6):981-986. |
 2012, Vol. 28
2012, Vol. 28


