全球经济化的发展、贸易的开通,交通的便捷,无不为各国旅行、探亲、交易打开了方便之门,人口流动速度加快,与此同时传染病的传播也随之蔓延[1]。为保障居民生命健康安全,进行国境口岸传染病病原抗体的快速筛查,为传染病的传入与传出建立一道屏障有重要意义[2]。本研究建立针对登革病毒、土拉菌、禽流感病毒、西尼罗病毒4种病原抗体高通量快速筛查的液相芯片检测方法。结果报告如下。
1 材料与方法 1.1 试剂登革病毒E2蛋白、西尼罗病毒E蛋白、鼠抗登革病毒2型抗体、兔抗西尼罗E蛋白血清(军事医学科学院微生物流行病研究所),禽流感H5抗原(哈尔滨兽医研究所),土拉fopA蛋白、兔抗土拉抗体(本实验室制备),藻红蛋白标记的链霉亲和素(streptavidin R-phycoerythrin,SAPE) (美国Invitrogen公司),93份健康人血清来自北京国际旅行卫生保健中心。
1.2 抗原包被微球按照Bio-rad公司产品微球交联试剂盒的操作手册,用不同抗原包被不同编号的羧基化编码微球,即一种抗原包被一种编号的编码微球,同时用牛血清白蛋白(bovine serum albumin,BSA) 、生物素化的BSA也包被不同编号的羧基化编码微球。
1.3 微球的质控将包被好的微球与对应的特异性抗体和样品稀释液进行检测,特异性抗体检测所得荧光值> 2 000,样品稀释液的荧光值< 100的说明包被成功可进行后续实验[3]。
1.4 单体系液相芯片检测方法将包被好的单一微球溶于检测缓冲液中使得微球浓度为70个/μL,检测时先用检测缓冲液将滤孔板润湿,加入50 μL含有3 500个微球的检测缓冲液,用洗液洗2次之后加入50 μL待检样品,室温孵育30 min,洗液洗3次后加入50 μL生物素化的葡萄球菌A蛋白(staphylococcal protein A,SPA),室温孵育30 min,洗液洗3次后加入50 μL浓度为4 ng/mL的SAPE,室温孵育10 min,洗液洗3次后加入150 μL检测缓冲液进行液相芯片仪检测荧光值,同时用样品稀释液作为空白对照[4]。
1.5 特异性检测按照1.4的单体系检测方法分别检测其他免疫血清,观察交叉反应结果。
1.6 单体系微球与ELISA方法检测的比较将免疫血清用样品稀释液做4倍比稀释,分别进行液相芯片方法与ELISA方法检测,比较2种方法的检测灵敏度和线性范围。
1.7 同步检测方法的建立将包被好的微球加入到检测缓冲液中使得6种微球均为70个/μL,检测时先用检测缓冲液将滤孔板润湿,加入50 μL含有6种微球的检测缓冲液(即每种微球含有3 500个),之后步骤与1.4后面相同。
1.8 同步检测登革病毒2型抗体和土拉菌抗体的灵敏度将登革病毒2型抗体、土拉菌抗体用样品稀释液4倍比稀释后,按照1.7步骤进行检测,得到标准曲线、标准曲线方程并计算检测灵敏度[5]。
1.9 液相芯片检测方法检测人血清的初步应用对93份健康人血清样品采用所建立的登革病毒抗体、土拉菌抗体、禽流感病毒抗体、西尼罗病毒抗体进行同步检测,检测所得荧光值的平均值与标准差的3倍之和作为判读阴阳性的临界值,高于临界值判为阳性,反之为阴性。
2 结果 2.1 抗原包被微球结果西尼罗E蛋白[WNV(E)]包被25号编码微球,土拉fopA蛋白(tula)包被28号编码微球,禽流感H5蛋白(H5)包被32号编码微球,登革病毒E2蛋白(DD2)包被31号编码微球,BSA包被2号编码微球,生物素化BSA包被45号编码微球,前4种抗原包被的微球作为相应抗体的检测项目,BSA包被的微球作为阴性质控,检测荧光值应该较低,生物素化BSA为阳性质控,检测荧光值较高,用于验证检测试剂SAPE与仪器检测光路的有效性。
2.2 特异性检测结果单体系液相芯片检测即单一微球体系检测对应抗体的荧光值较高,与其他免疫血清或抗体的荧光值接近于空白对照的荧光值,所以说明选用的抗原特异性强,与其他抗体不发生交叉反应。
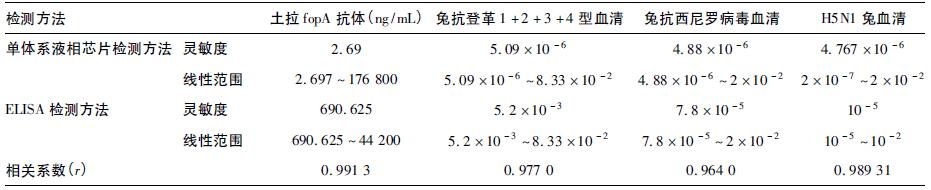
2.3 单体系与ELISA方法检测结果(表 1)| 表 1 单体系液相芯片检测方法与ELISA检测方法检测结果 |
表 1可见,单体系液相芯片方法灵敏度比ELISA方法高,线性范围宽,但2种方法有很好的一致性。
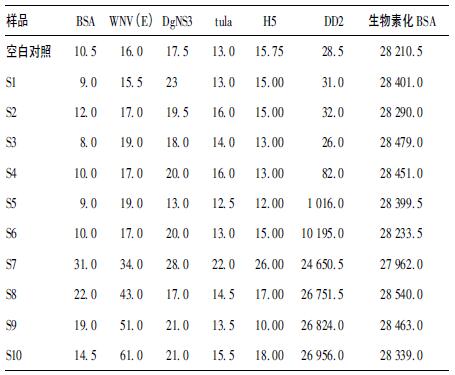
2.4 液相芯片检测登革病毒抗体结果(表 2)| 表 2 液相芯片检测登革热2型IgG的MFI值 |
鼠抗登革病毒2型IgG以4倍梯度稀释,检测的抗体浓度范围是S1~S10:4.0 ng/mL~1.06 mg/mL,有10个浓度梯度,标准曲线方程为FI=-0.193 944 + (27 086.5 +0.193 944)/[1+(Conc/71.928 7)-1.745 7]1.257 19,据空白对照(blank)计算得到的检测鼠抗登革病毒2型IgG灵敏度为3.39 ng/mL。4种病原抗体液相芯片同步检测方法检测鼠抗登革病毒2型IgG所得到荧光强度中位值(median fluorescence intensity,MFI)见表 2。鼠抗登革病毒2型IgG与其他3种抗原无交叉反应,当浓度达到66 250 ng/mL时,微球上抗原结合位点达到饱和,浓度再高,微球上也无多余的结合位点,荧光值会基本保持。
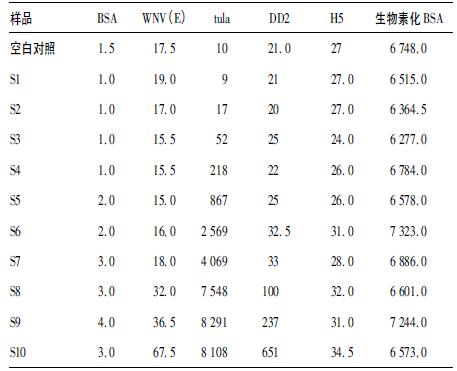
2.5 液相芯片检测土拉fopA IgG结果(表 3)| 表 3 液相芯片检测土拉fopA IgG的MFI值 |
土拉fopA IgG 4倍梯度稀释,检测的抗体浓度范围是S1~S10:0.168 ng/mL~44.2 μg/mL,包含10个浓度点,液相芯片检测兔抗土拉fopA IgG标准曲线方程:FI=-2.355 17 + (9 047.57 +2.355 17)/[1 + (Conc/634.508)-0.629 63]2.006 22,灵敏度为5.0 ng/mL。4种病原抗体液相芯片同步检测方法检测土拉fopA IgG所得到MFI值见表 3。可看出除在土拉fopA的抗体浓度为11.05 μg/mL和44.2 μg/mL时与包被有登革E2蛋白的微球有轻微交叉反应,其他均无交叉,其特异性较好,当浓度达到11.05 μg/mL时MFI值达到最高时,说明表面位点饱和,当浓度再高时MFI值反而下降,出现了抗原抗体反应中抗体过剩,出现"前带"现象,所以当检测样品中抗体浓度过高时应稀释后再检测。
2.6 液相芯片检测人血清结果建立的液相芯片检测体系用于检测93份人血清中西尼罗、登革病毒、土拉菌、禽流感抗体阳性率分别为3.23%、4.30%、3.23%、3.23%;特异度分别为96.77%、95.70%、96.77%、96.77%。
3 讨论本实验中所用的人血清为乙肝、丙肝、梅毒、检测阴性的血清样,具体人员的患病史均无详细资料,每个检测项目特异度> 95%,表明选用的抗原与血清中的抗体有非特异性结合,但这是不可避免的,因人血清成分复杂,个体差异也较大,还有一些异嗜抗体的存在[6],导致出现一定的阳性率[7],应对筛查结果检测得到阳性的样品进一步进行检测,已确诊是否为该病原感染。
液相芯片技术可对核酸和蛋白质等生物大分子进行高通量多指标检测,既满足了高通量检测的要求,同时还具备快速准确,灵敏度高,特异性好,结果重复性好等优点[8, 9, 10]。本研究中所建立的液相芯片方法不仅可以定性检测4种病原抗体,还可进行定量检测,在定量检测过程中抗原的提纯度,标准品的定值准确性、抗体的亲和性、滴度和特异性,标记物的比活性和免疫活性等都对检测结果有直接影响[11]。
| [1] | 吴小敏,吴永胜,程锦泉.气候变化与传染病关系研究进展[J].中国公共卫生,2010,1(26):127-128. |
| [2] | Aytur T,Foley J,Anwar M,et al.A novel magnetic bead bioassay platform using a microchip-based sensor for infectious disease diagnosis[J].Journal of Immunological Methods,2006,314(1-2):21-29. |
| [3] | 王静,单麟军,杨永利,等.悬浮芯片定量检测鼠疫菌的方法研究[J].卫生研究,2009,38(5):607-611. |
| [4] | Jochen MS,Ulrika I,Bernet SK,et al.Comparative protein profiling of serum and plasma using an antibody suspension bead array approach[J].Proteomics 2010,10:532-540. |
| [5] | Mary TM,Stuart G,Maurice P,et al.Multiplexed liquid arrays for simultaneous detection of simulants of biological warfare agents[J].Analytical Chemistry,2003,75(8):1924-1930. |
| [6] | Martins TB.Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile[J].Clinical and Diagnostic Laboratory Immunology, 2002,9(1):41-45. |
| [7] | 张锦海,王忠灿,王长军.禽流感快速检测技术研究进展[J]. 中国公共卫生,2009,7(25):865-867. |
| [8] | Verkaik N,Brouwer E,Hooijkaas H,et.al.Comparison of carboxylated and penta-his microspheres forsemi-quantitative measurement of antibody responses to His-tagged proteins[J].Journal of Immunological Methods,2008,335:(1-2)121-125. |
| [9] | Watson DS,Reddy SM,Brahmakshatriy V,et al.A multiplexed immunoassay for detection of antibodies against avian influenza virus[J].Journal of Immunological Methods,2009,340(2): 123-131. |
| [10] | 陈玮.液相芯片技术的原理与应用进展[J].成都医学院学报,2008,3(3):225-231. |
| [11] | Christian P,Nanette S,Frank V.Effect of serum content and diluent selection on assay sensitivity and signal intensity in multiplex bead-based immunoassays[J].Journal of Immunological Methods,2008,329:214-218. |
 2012, Vol. 28
2012, Vol. 28