研究表明,镉能够引起细胞凋亡,并且线粒体受损是镉毒性的首要靶点[1]。细胞凋亡时,线粒体膜通透性增加,释放可溶性线粒体膜间隙蛋白质,进一步破坏细胞结构。在这些致死性蛋白质中,核酸内切酶G(endonuclease G,Endo G) 是以非胱门蛋白酶 (统称为胱冬肽酶,caspases) 依赖方式发挥作用的细胞凋亡因子之一[2, 3, 4]。研究表明,Endo G 过表达会使采用脱氧核苷酸末端转移酶介导的缺口末端标记法(TUNEL) 的比率明显增加[5]。为了探讨 Endo G 基因过表达在镉诱导人胚胎肾细胞(HEK-293) 凋亡中的作用,本研究选取人肝癌细胞株(human hepatocarcinoma cells,HepG 2) ,采用聚合酶链反应(PCR) ,扩增Endo G 基因,构建pcDNA 3.0-EndoG 真核表达载体,转染人胚胎肾细胞HEK-293 细胞后,观察转染基因表达以及对细胞增值的影响。现将结果报告如下。
1 材料与方法 1.1 材 料人肝癌细胞HepG 2 系(本实验室冻存) ; pcDNA 3.0 质粒、pcDNA 3.0-GFP 质粒、大肠埃希菌(E.coli) DH5α 菌株以及人胚肾细胞HEK-293 (本实验室保存) ; Trizol 试剂(南京丁贝生物公司) ; pMD18T(上海生工生物工程有限公司) ; 限制性内切酶BamH I、Hind III 和T4DNA 连接酶以及 DNA Marker(大连宝生物工程有限公司) ; 达尔伯克改良伊格尔(Dulbeceo's modified eagle's medium,DMEM) 培养基(美国Gibco 公司) ; 兔抗Endo G 单克隆抗体和鼠抗兔Ig G 多克隆抗体(德国Santa Cruz 公司) ; 检测蛋白质浓度试剂和超强信号显影剂(美国Pierce 公司) ; 其他常规化学试剂均为国产分析纯。
1.2 方 法 1.2.1 引物设计根据GenBank 中公布的人源 Endo G 基因序列,采用引物(primer) 设计软件,设计1 对引物,两端分别引入Hind III 和BamH I 酶切位点,并在Hind III 酶切位点后加入Kozak 序列高效转录增强子和flag 标签。Endo G 蛋白为35 kDa,flag 标签为1 kDa,目的蛋白表达为36 kDa。引物 P1: 上游引物5'-AGCTAAGCTTGCCATGGACTACAAGGACGACGATGATAAGATGGCTATCAAGAGTATC-3'; P2: 下游引物5'-AGCTG GATCCCTAGGATGGCTTTCTTATCTG-3'。引物由上海生工生物技术有限公司合成。
1.2.2 Endo G 基因扩增与重组质粒鉴定用Trizol 试剂提取HepG 2 细胞总RNA,经逆转录反应合成互补DNA(complementary DNA,cDNA) ,以此为模板进行PCR,扩增Endo G 基因。反应条件: 94 ℃ 变性30 s,61 ℃ 退火30 s,72 ℃ 延伸1.5 min,30 个循环,最后72 ℃ 延伸10 min。扩增产物在1% 的琼脂糖凝胶中电泳分离目的片段,迅速割胶,按照说明书回收基因。并将基因与pMD18T 载体连接,挑取阳性克隆后提取重组质粒,用Hind III 和BamH I 2 种限制性内切酶进行双酶切后电泳鉴定。将确定为阳性克隆的重组质粒送上海生工生物工程技术服务有限公司进行序列测定,并将测序结果与Gen-Bank 中公布的人源Endo G 基因序列对比。
1.2.3 真核表达载体(pcDNA 3.0-Endo G) 构建及鉴定用Hind III 和BamH I 将Endo G 片段释出,并将pcDNA 3.0 进行双酶切,按照基因与载体的摩尔比10∶ 1,在10 μL 连接反应体系中依次加入如下各组分: 4 μL 灭菌蒸溜水,1 μL 的10 × buffer,1 μL 的T4 连接酶,1 μL 酶切的pcDNA 3.0,3 μL 的Endo G 基因,轻轻混匀后,16 ℃ 水浴过夜(连接时间> 16 h) 。次日取连接产物10 μL,转化感受态细胞DH5α,倒入含氨苄青霉素的Luria-Bertani (LB) 固体培养基上,置37 ℃ 孵箱过夜。随机挑取菌落,进行菌落PCR,提取重组质粒。同时取1 mL 菌液送上海生工生物工程技术服务有限公司测序,并将测序结果与GenBank 中公布的人源Endo G 基因序列对比。抽提纯化的重组质粒PCR 扩增和双酶切,进行琼脂糖凝胶电泳鉴定,观察Endo G 基因条带。
1.2.4 磷酸钙法转染人胚胎肾细胞(HEK-293)将HEK-293 细胞培养于培养板内,以铺板后1 ~ 2 d 内长到70% ~ 80%为宜。在转染前30 ~ 60 min,吸去培养液,加入新鲜的不含抗生素的完全培养液。 将pcDNA 3.0 和pcDNA 3.0-EndoG 分别与少量 pcDNA 3.0-GFP 混匀,各做成DNA-氯化钙-BBS 混合物,均匀滴加到相应的孔内。在37 ℃ 含5% CO2 细胞培养箱内培养。12 h 后轻轻晃动培养板数次以充分悬浮一些磷酸钙沉淀,吸去含磷酸钙沉淀的培养液,加入新鲜完全培养液,继续培养。转染约 32 h 后在荧光显微镜下观察绿色荧光。
1.2.5 Endo G 蛋白过表达检测将HEK-293 细胞以5 ×104左右的密度接种到6 孔板,待密度达到约 70% 时开始转染细胞。实验分6 组: (A) 不加任何处理的HEK-293 细胞作为对照组,(B) 用pcDNA 3.0 / pcDNA 3.0-GFP 转染细胞,(C) 用pcDNA 3.0-Endo G/pcDNA 3.0-GFP 转染细胞,(D) 用pcDNA 3.0-Endo G/pcDNA 3.0-GFP + 20 mmol /L CdCl2 转染细胞,(E) 用pcDNA 3.0-Endo G/pcDNA 3.0-GFP + 40 mmol /L CdCl2 转染细胞,(F) 用pcDNA 3.0-Endo G/ pcDNA 3.0-GFP + 60 mmol /L CdCl2 转染细胞; 3 组 CdCl2 处理均为8 h。32 h 后,抽提细胞总蛋白并通过蛋白印迹试验分析Endo G 蛋白表达情况,兔抗 Endo G 单克隆抗体(一抗) 稀释浓度为1∶ 2 000,鼠抗兔IgG 多克隆抗体(二抗) 的稀释浓度为1 ∶ 5 000。分析比较各组中Endo G 蛋白表达量的变化趋势。
1.2.6 Endo G 基因过表达对镉诱导HEK-293 细胞凋亡的影响(1) 采用吖啶橙/溴乙锭(AO/EB) 双染法检测Endo G 基因过表达对镉诱导HEK-293 细胞凋亡的影响。将细胞接种于12 孔板,进行磷酸钙转染,实验分组同上,转染时间同上。设置 CdCl2 的浓度梯度为20、40 和60 μmol /L,对照组加入等体积生理盐水,处理8 h。取细胞悬液100 μL,加入AO、EB 染料4 μL 混匀,置1 滴于载玻片,上覆盖玻片,根据原理: 吖啶橙(AO) 能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。溴乙锭(EB) 仅能透过胞膜受损的细胞,嵌入核 DNA,发橘红色荧光。在490 nm 激发波长的荧光显微镜下观察并记录。(2) 采用流式细胞术检测 Endo G 蛋白过表达对镉诱导HEK-293 细胞凋亡的影响。将处于对数生长期的HEK-293 细胞种到6 孔板内,贴壁后进行转染,Endo G 基因在转染后 24 h 开始表达,设置CdCl2 作用8 h 的剂量梯度为 20、40 和60 μmol /L 的实验组,对照组加入等体积的生理盐水。收集细胞样品,用碱性磷酸酶缓冲液洗涤2 遍。用凋亡检测试剂Annexin-V-PE 和 7-AAD 染色后,制备成1 × 106 个/mL 的细胞悬液。 各取1 mL 上述细胞悬液于流式管中,1 h 内上流式细胞仪检测。观察细胞处于早期凋亡、晚期凋亡,坏死情况。
1.2.7 Endo G 基因过表达对HEK-293 细胞活性的影响采用噻唑蓝法(MTT) 检测Endo G 基因过表达对HEK-293 细胞活性影响。培养HEK-293 细胞至指数生长期,用0.25% 胰蛋白酶消化传代,将密度为1 × 104 个/mL 的细胞悬液接种于96 孔板培养。按照磷酸钙转染步骤进行转染,实验分组同上,每组设5 个平行孔。每孔加入10 μL 的5 mg /mL MTT 溶液,37 ℃ 孵育4 h 后,2 000 r /min,离心5 min,小心吸弃MTT 液体,加入150 μL 二甲基亚砜,震荡10 min,使蓝色结晶沉淀完全溶解。用酶标仪于波长570 nm 处测A 值,A 值越小表明细胞存活率越低。
1.3 统计分析采用SPSS 8.0 软件进行统计分析,组间比较采用t检验。
2 结 果 2.1 Endo G 基因扩增片断(图 1) | 注: 1: Marker(2 000 bp) ; 2: Endo G 基因。 图 1 Endo G 基因PCR 扩增结果 |
PCR 扩增结果显示,扩增到大小约为1 100 bp 左右的目的条带,条带明亮单一,背景清晰,可确定为Endo G 的基因片段。
2.2 pcDNA 3.0-Endo G 质粒构建与鉴定(图 2 ~4) | 注: 1: Marker(2 000 bp) ; 2 ~ 5: 阳性克隆。 图 2 菌落PCR 扩增结果 |
 | 注: 1: Marker(10 Kb) ; 2: pcDNA 3.0 空载质粒; 3: 重组质粒pcDNA 3.0。 图 3 重组质粒电泳鉴定 |
 | 注: 1: Marker (2 000 bp) ; 2: 阳性菌株中经双酶切后的 pcDNA 3.0-Endo G载体; 3: 从阳性菌株未经任何处理的pcDNA 3.0-Endo G 载体。 图 4 重组质粒酶切鉴定 |
(1) 菌落目的基因扩增片断(图 2) : 以菌落为模板,PCR 扩增结果显示,扩增到Endo G 基因,大小约为 1 100 bp,与目的基因条带大小相同。条带明亮单一,背景清晰,可确定为阳性克隆菌落。(2) 重组质粒电泳鉴定(图 3) ,重组质粒电泳条带明显滞后,表明双酶切后的pcDNA 3.0 中有基因插入,初步鉴定真核表达载体pcDNA 3.0-Endo G 构建成功。(3) 双酶切鉴定(图 4) : 双酶切后的pcDNA 3.0-Endo G 有2 个条带,最前面的1 个条带大小与未经处理的 pcDNA 3.0-Endo G 相似,后面1 个条带和目的基因大小一致。表明Endo G 基因正确插入了双酶切后的pcDNA 3.0 载体中,pcDNA 3.0-Endo G 质粒构建成功。(4) 测序鉴定: 含有pcDNA 3.0-Endo G 载体的菌液基因测序结果显示,正反两向引物所扩增出的基因序列与从数据库提取的序列相同,可确认 pcDNA 3.0-EndoG 构建成功。
2.3 pcDNA 3.0-Endo G 转染细胞本实验中,采取含有绿色荧光蛋白pcDNA 3.0-GFP 载体与pcDNA 3.0-Endo G 载体进行共转染。转染时间32 h,荧光显微镜下可见视野里有清晰的绿光,表明瞬时转染成功。
2.4 镉诱导HEK-293 细胞中Endo G 蛋白的过表达(图 5) | 注: 1: 不加任何质粒转染细胞(空白对照) ; 2: 转染空载pcDNA 3.0 细胞; 3: 转染pcDNA 3.0-Endo G 细胞; 4、5、6: 转染pcDNA 3.0-Endo G 的细胞分别加入20、40 和60 μmol /L CdCl2。 图 5 重组质粒的蛋白表达 |
Western blot 检测结果显示,与空白对照和空载质粒的蛋白表达条带(图 5 条带1 和2) 比较,转染pcDNA 3.0-EndoG 细胞及加入CdCl2 各组的蛋白表达条带明显加深,条带位置约为36 kDa,与目的蛋白大小一致。表明Endo G 真核表达载体 pcDNA 3.0-EndoG 可在细胞中成功过表达,并且随着CdCl2 浓度增加,细胞凋亡率增加,Endo G 蛋白表达量出现先升高后下降趋势。
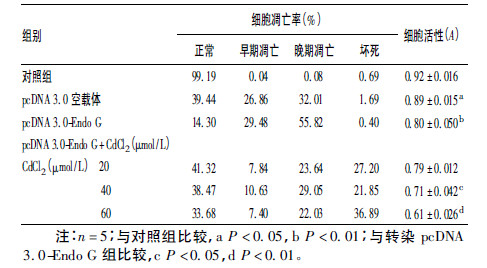
2.5 Endo G 蛋白过表达对细胞凋亡及活性的影响(表 1)| 表 1 Endo G 蛋白过表达对镉诱导HEK-293 细胞凋亡率及细胞活性比较 |
AO/EB 染色法检测结果显示,过表达 Endo G 蛋白后细胞凋亡率明显增加,达37% 以上,表明Endo G 具有明显的促凋亡作用。加入CdCl2 后与Endo G 共同作用,结果显示,随着CdCl2 诱导浓度增加,细胞凋亡率持续升高。流式细胞术检测结果显示,在Endo G 单独作用下,细胞以早期凋亡和晚期凋亡为主。加入CdCl2 后,由于Endo G 表达量随CdCl2 浓度增高而降低,细胞坏死率升高,提示 Endo G 在凋亡信号通路中以诱导细胞凋亡为主要形式,CdCl2 处理的细胞除了出现凋亡形式外,还出现较大比例的坏死现象。MTT 法检测结果显示,转染pcDNA 3.0 空载质粒组A 值与空白对照组差异无统计学意义(P > 0.05) ,转染pcDNA 3.0-Endo G 各组及不同浓度CdCl2 处理组的HEK-293 细胞增殖活性均低于空白对照组,差异均有统计学意义(均P < 0.01) ,表明转染pcDNA 3.0-Endo G 和加入CdCl2 处理后,HEK-293 细胞增殖明显受到抑制。与转染pcDNA 3.0-Endo G 组比较,加CdCl2 诱导各组A 值呈明显降低趋势,差异均有统计学意义(均P < 0.01) ,表明CdCl2 对细胞毒害作用明显。提示本研究制备的pcDNA 3.0-Endo G 载体有一定抑制细胞增殖的生物学作用,Endo G 与 CdCl2 是2 个致细胞凋亡的因素。
3 讨 论已有研究表明,镉在引起细胞线粒体凋亡信号通路中,线粒体膜通透性增加,释放可溶性线粒体膜间隙蛋白质,进一步破坏细胞结构。在这些致死性蛋白质中,有些(Cyt c、Smac /DIABLO、Omi /HtrA2 等) 能够激活caspases,另一些凋亡因子(如Endo G、 AIF、Omi /HtrA2 等) 则以非Caspase 依赖的方式发挥作用。多种线粒体因子参与细胞凋亡,强化了细胞器在凋亡控制中的核心作用[6, 7]。本实验室研究已发现[8, 9, 10],镉能够引起线粒体渗透性转化孔(mitochondrial permeability transition pore,MPTP) 的开放、线粒体膨胀、线粒体膜电位下降,Cyt c 与凋亡诱导因子(apoptosis-inducing factor,AIF) 释放,ROS 含量的增加以及和氧化应激相关的酶活性降低等一系列与细胞凋亡相关事件的发生。
pcDNA 3.0 质粒是目前在各种哺乳动物细胞中能获得高水平蛋白表达的真核表达载体之一。本研究在引物设计中加入Kozak 序列高效转录增强子,可以明显提高转录效率而增加重组蛋白的产量,为体外研究Endo G 蛋白提供了可能。本实验利用RT-PCR 技术成功构建pcDNA 3.0-Endo G 重组真核表达载体,结果显示,Endo G 蛋白可以在HEK-293 细胞中成功过表达。加入CdCl2 后,在Endo G 和CdCl2 二者共同作用下,随着CdCl2 浓度增加,Endo G 蛋白表达量先上升后下降。通过MTT 检测到过表达Endo G 的 HEK-293 细胞组的A 值明显下降,通过AO/EB 检测到Endo G 有明显的促进HEK-293 细胞凋亡作用,加入CdCl2 后细胞存活率大幅度下降。流式细胞术检测发现,在Endo G 单独作用下,细胞以早期凋亡和晚期凋亡为主,加入CdCl2 诱导后,细胞出现严重坏死现象。 提示Endo G 在凋亡信号通路中以诱导细胞凋亡为主要形式,而CdCl2 诱导的细胞除了出现凋亡形式外,还出现明显的坏死现象。
上述结果仅为本研究的初步结果,下一步将采用RNA 干扰方法降低Endo G 表达,观察其与细胞内其他凋亡因子的相互作用关系,这些为最终阐明线粒体到细胞核凋亡通路中,Endo G 的作用途径与作用机理十分必要。
| [1] | Hamada T,Sasaguri T,Tanimoto A,et al.Apoptosis of human kidney 293 cells is promoted by polymerized cadmium-metallothionein[J].Biochem Biophys Res Commun,1996,219(3):829-834. |
| [2] | Kim J,Lee J,Jeong W,et al.Reactive oxygen species-dependent Endo G release mediates cisplatin-induced caspase-independent apoptosis in human head and neck squamous carcinoma cells[J]. Int J Cancer,2008,122(3):672-680. |
| [3] | Hanzel C,Verstraeten S.Tl(I)and Tl(III)activate both mitochondrial and extrinsic pathways of apoptosis in rat pheochromocytoma(PC12)cells[J].Toxicol Appl Pharmacol,2009,236(1): 59-70. |
| [4] | Ghavami S,Eshraghi M,Kadkhoda K,et al.Role of BNIP3 in TNF-induced cell death-TNF upregulates BNIP3 expression[J]. Biochim Biophys Acta,2009,1793(3):546-560. |
| [5] | Rico E,Alzate J,Arias A,et al.Leishmania infantum expresses a mitochondrial nuclease homologous to Endo G that migrates to the nucleus in response to an apoptotic stimulus[J].Mol Biochem Parasitol,2009,163(1):28-38. |
| [6] | 汤新慧,高静,徐强.线粒体电压依赖性阴离子通道及其调控功能[J].细胞生物学杂志,2005,27(2):113-116. |
| [7] | 钱琼秋,宰文姗,何勇,等.外源硅和辅酶Q10对盐胁迫下黄瓜根系线粒体的保护作用[J].中国农业科学,2006,39(6): 1208-1214. |
| [8] | 田婷,毛伟平,张超,等.镉致HEK293细胞凋亡中氧化应激作用[J].中国公共卫生,2007,23(10):1192-1193. |
| [9] | Mao W,Ye J,Guan Z,et al.Cadmium induces apoptosis in human embryonic kidney(HEK)293 cells by caspase-dependent and independent pathways acting on mitochondria[J].Toxicology In Vitro,2007,21(3):343-354. |
| [10] | 毛伟平,张娜娜,魏传静,等.镉致HEK293细胞线粒体损伤作用[J].中国公共卫生,2008,24(12):1531-1533. |
 2012, Vol. 28
2012, Vol. 28