肥胖是一种能量摄入大于能量消耗的营养代谢性疾病。近年来,肥胖发病率迅速上升并越来越引起人们的重视。饮食诱导肥胖与肥胖抵抗模型的建立有助于研究人类肥胖产生机制[1]。小肠是机体主要的消化吸收器官,与瘦的zucker 大鼠相比,肥胖大鼠小肠葡萄糖吸收能力较低; 遗传性肥胖和瘦的小鼠小肠营养素的转运存在差异。此外,肥胖人群对食物吸收有更高效率。本研究采用饮食诱导肥胖易感与肥胖抵抗大鼠模型,探索2 种表型大鼠形成过程与小肠糖类吸收关联性。
1 材料与方法 1.1 实验动物雄性SD 大鼠( 北京维通利华实验动物有限公司) 48 只,体重150 g 左右,许可证编号: SCXK( 京) 2006-0009。单笼饲养,喂饲块状基础饲料,适应环境1 周。
1.2 主要试剂与仪器葡萄糖( 天津天大净化材料精细化工厂) ,D-木糖( 上海蓝季科技发展有限公司) ,D-木糖测定试剂盒( 南京建成生物研究所) 。血糖仪和血糖试纸( 美国强生公司) ,高速冷冻离心机( 美国贝克曼库尔特有限公司) ,722-分光光度计( 上海第三分析仪器厂) 。
1.3 方法 1.3.1 饮食诱导肥胖和肥胖抵抗大鼠模型建立饮食诱导肥胖( diet-induced obesity,DIO) 和饮食诱导肥胖抵抗( diet-induced obesity resistance,DR) 大鼠筛选参考Levin[2, 3] 方法。大鼠用脂肪供能占 60%高脂饲料喂养2 周后,按体重增加量将大鼠分为3 组: 体重增加量位于上1 /3 为DIO 组; 体重增加量位于下1 /3 为DR 组; 中间1 /3 剔除。DIO 组和 DR 组大鼠继续饲喂高脂饲料6 周。动物自由摄食饮水,记录给食量和撒食量,每周称体重1 次。实验中使用的高脂饲料每克含有23.53 kJ 能量,其中脂肪、碳水化合物和蛋白质提供能量百分比分别为 59.4%、19.8%和20.6%。
1.3.2 食物效能计算食物效能( feed efficiency) = 体重获得( g) /能量消耗( kJ) 。
1.3.3 口服葡萄糖耐量试验每组随机选取8 只大鼠,禁食过夜,50% 葡萄糖溶液灌胃( 2 g /kg) ,分别取灌胃前和灌胃后30、60、90 和120 min 尾血,用血糖仪测量血糖。
1.3.4 口服D-木糖耐量试验另8 只大鼠,禁食过夜后,用20%D-木糖溶液( 0.8 g /kg) 灌胃,分别取灌胃前和灌胃后1、2、3 和4 h 尾血,3 000 r /min 离心15 min 取上清,使用D-木糖试剂盒测定血清 D-木糖浓度。
1.4 统计分析所有数值以x± s 表示。采用SPSS 13.0 软件进行数据分析和统计,2 组数据比较使用t 检验。P < 0.05 为差异有统计学意义。
2 结果 2.1 DIO 大鼠和DR 大鼠体重与摄食量变化( 表 1)| 表 1 DIO 大鼠与DR 大鼠体重变化( x± s,n = 16) |
2 组大鼠体重差异从第2 周开始有统计学意义; DIO 大鼠和DR 大鼠摄食量分别为( 417.8 ± 33.5) kJ /d 和( 379.3 ± 40.2) kJ /d,2 组大鼠在8 周内周摄食量 DIO 组大鼠均高于DR 组大鼠( t =-2.54 ~-6.42,P < 0.01) 。
2.2 DIO 大鼠和DR 大鼠食物效能比较第8 周末,DIO 组和DR 组大鼠食物效能分别为( 1.5 ± 0.1) × 100 g /kJ 和( 1.3 ± 0.1) × 100 g /kJ,2 组比较差异有统计学意义( t =-3.5,P < 0.01) 。
2.3 DIO 大鼠和DR 大鼠口服葡萄糖耐量比较( 图 1)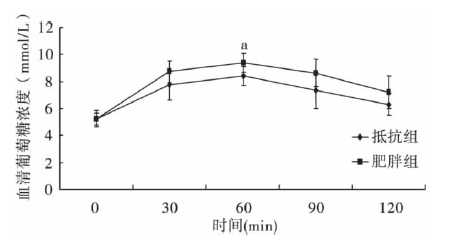 | 图 1 DIO 大鼠和DR 大鼠血清D - 木糖值动态变化 |
DIO 和DR 大鼠空腹血糖分别为( 5.2 ± 0.6 ) 、 ( 5.2 ± 0.4) mmol /L; 2 组大鼠60 min 血糖分别为 ( 9.0 ± 1.3) 和( 8.4 ± 0.7) mmol /L,差异有统计学意义( t =-2.7,P < 0.05) 。DIO 组大鼠葡萄糖曲线下面积[( 16.5 ± 1.2 ) mmol /( L·h)] > DR 组大鼠 [( 14.6 ± 1.5 ) mmol /( L·h )]( t =-2.75,P < 0.05) 。
2.4 DIO 大鼠和DR 大鼠口服D-木糖耐量比较( 图 2)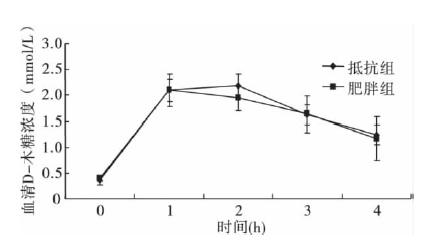 | 注: a P<0.05。图 2 DIO 大鼠和DR 大鼠血糖值动态变化 |
灌胃后2 h,DR 组大鼠血清D-木糖浓度高于DIO 组趋势,但差异无统计学意义; 其余时间点差异均无统计学意义。D-木糖曲线下面积差异也无统计学意义。
3 讨论Levin 等人建立的动物模型由同一品系鼠经高脂饮食诱导产生不同肥胖易感表型,这与人类十分相似。此研究的结果与较早的大鼠4 周高脂饮食暴露发展成2 种不同表型的研究结果一致[3, 4]。本研究结果表明,DIO 鼠每周摄食量明显高于DR 鼠,提示DIO 组大鼠可能更喜食高脂饲料,从而在高脂饮食的诱导下,摄食量增加,体重增加。食欲过剩是 DIO 和DR 2 种不同表型产生的主要原因[5]。食物效能反映食物利用情况,食物效能高说明实验对象更容易将食物中能量储存起来,将其转化为自身脂肪并表现为体重的增加。有研究表明硫辛酸可以降低食物效能并在给予高脂膳食的情况下抑制体重增加[6]。本研究结果显示,DIO 组大鼠食物效能明显高于DR 组,与以往研究结果一致[5]。提示DIO 组大鼠更容易将食物中的能量转化为体脂储存起来。
本研究结果还显示,DIO组大鼠对葡萄糖的吸收能力高于DR 组,这可能与Na + 依赖性单糖转运体1( SGLT-1) 和易化性单糖转运体2( GLUT-2) 2 种转运体蛋白在2 组大鼠中的表达差异有关[7]。 减少食物中葡萄糖摄入或抑制葡萄糖吸收是否会减轻DIO 组大鼠体重还有待进一步研究。
| [1] | 麻微微,王舒然,蔺威明,等.饮食诱导肥胖和肥胖抵抗大鼠胃肠动力学研究[J].中国公共卫生,2007,23(4):431-432. |
| [2] | Jin HX,Jian D,Chen DZ.Alterations of gastrointestinal motility in obesity[J].Obes Res,2004,12:1723-1732. |
| [3] | Levin BE,Keesey RE.Defense of differing body weight set points in diet-induced obese and resistant rats[J].Am J Physiol,1998, 274:R412-419. |
| [4] | Chandler PC,Viana JB,Oswald KD,et al.Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J].Physiol Behav,2005,85:221-230. |
| [5] | Sfecikova Z,Hajek T,Lenhardt L,et al.Different functional responsibility of the small intestine to high-fat/high-energy diet determined the expression of obesity-prone and obesity-resistant phenotypes in rats[J].Physiol Res,2008,57:467-474. |
| [6] | Prieto-Hontoria PL,Pérez-Matute P,Fernández-Galilea M,et al. Lipoic acid prevents body weight gain induced by a high fat diet in rats:effects on intestinal sugar transport[J].J Physiol Biochem, 2009,65(1):43-50. |
| [7] | Hyland NP,Rybicka JM,Ho W,et al.Adaptation of intestinal secretomotor function and nutrient absorption in response to diet-induced obesity[J].Neurogastroenterol Motil,2010,22(6): 602-e171. |
 2012, Vol. 28
2012, Vol. 28



