2. 武警后勤部疾病预防控制中心;
3. 山东大学医学院生物化学与分子生物学研究所
大肠癌( colorectal cancer,CRC) 包括直肠癌和结肠癌,是常见的恶性肿瘤之一,全世界范围内大肠癌的发病率处于恶性肿瘤的第3 位[1]。中国抗癌协会临床肿瘤学协作专业委员会公布的最新数据表明,大肠癌在我国目前总人群的发病率为20 /10 万,发病率占常见肿瘤的第4 位,2008 年上海市大肠癌的发病率占恶性肿瘤的第2 位[2]。目前治疗大肠癌首选手术以及术后常规化疗,手术后5 年生存率< 40%[3]。化疗和放疗的联合应用取得一定疗效,但不令人满意。所以探求一种新的治疗方法尤为重要。泛素结合酶UbcH10 ( ubiquitin-conjugating enzymes,UbcH10) 属于泛素结合酶E2 家族的成员,是第10 个被识别的人泛素结合酶,参与泛素介导的蛋白质降解过程[4]。同时,UbcH10 也是参与细胞周期调控的关键因子之一,通过与细胞后期促进复合物APC 相互作用影响有丝分裂纺锤体装配检测点驱动细胞周期的进展[5]。早期研究报道了 UbcH10 基因在大肠癌肿瘤组织的表达明显高于癌旁正常组织,而且与肿瘤的分化程度有关[6]。本研究采用shRNA 沉默UbcH10 基因的表达,观察其对裸鼠移植大肠癌的抑制作用,为大肠癌治疗的方法学研究提供理论依据。
1 资料与方法 1.1 材料与试剂 1.1.1 主要试剂RPMI 1640 培养基和优质胎牛血清( 美国Hyclone 公司) ,转染试剂LipofectamineTM 2000( 美国Invitrogen 公司) ,UbcH10 抗体( 中国台湾 Abnova 公司) ,β-actin 及二抗( 美国Santa Cruz 公司) ,电化学发光试剂盒( 美国Millipore 公司) 。
1.1.2 实验动物5 周龄BALB /c-nu 裸鼠15 只 [上海斯莱克实验动物有限公司,动物合格证号 SCXK( 沪) 2007-0005],无特定病原体条件下饲养。
1.1.3 细胞株人大肠癌细胞株HT-29 购自中科院上海细胞所。
1.2 实验方法 1.2.1 shRNA 表达载体的构建针对UbcH10 编码区的特异性RNA 干扰序列: 5'-AACCTGCAAGAAACCTACTCA-3'; 阴性对照序列为: 5'-AACTAACACTAGCTCAAGACC-3'。针对UbcH10 基因的shRNA 表达载体pGPU6 /GFP /Neo / UbcH10-RNAi( pUbcH10-RNAi) 及其阴性对照表达载体pGPU6 /GFP /Neo /UbcH10-NC( pRNAi-NC) 的构建由上海吉玛制药技术有限公司完成,表达载体包含绿色荧光蛋白标记。
1.2.2 细胞培养及沉默细胞系的建立HT-29 细胞用含10% 胎牛血清的RPMI 1640 培养基,在 37 ℃、5% CO2 饱和湿度条件下传代培养,选用对数生长期细胞进行实验。转染前24 h 胰酶消化处于对数生长期的细胞以5.0 × 104 /mL 的浓度接种培养板,次日细胞融合率达到80% 左右时进行转染。实验操作按转染试剂LipofectamineTM 2000 的说明进行,实验用转染试剂LipofectamineTM 2000 与表达载体的重量比为2.5: 1,转染48 h 后加G418 进行筛选维持。
1.2.3 蛋白印迹法( western blot ) 检测细胞 UbcH10 蛋白表达裂解细胞取40 μg 蛋白进行 12.5%聚丙烯酰胺凝胶电泳,电泳完毕后转印蛋白至硝酸纤维素膜( NC 膜) ,转膜电流175 mA,30 min。封膜后加入UbcH10 抗体( 1: 800 稀释) 和 β-actin 抗体( 1: 5 000 稀释) 4 ℃过夜,反应结束后用磷酸盐缓冲液洗3 次,每次5 ~ 10 min。然后加入脱脂奶粉配制的二抗( 1: 10 000 稀释) 室温孵育2 h,再次洗膜3 次,每次5 ~ 10 min。最后加入电化学发光光敏剂A 液和B 液,将硝酸纤维素膜X 光胶片暗盒曝光,显影,定影。
1.2.4 体内抑瘤实验裸鼠15 只随机分为3 组,包括未转染组( HT-29 /PBS) 、阴性对照组( HT-29 / RNAi-NC) 和实验组( HT-29 /UbcH10-RNAi) 。取对数生长期的各组细胞胰酶消化后调节细胞浓度为 1.0 × 107 /mL。每只裸鼠接种200 μL 细胞悬液于一侧协腹皮下。接种8 d 后每4 d 测量1 次肿瘤的长径和短径,计算肿瘤体积。体积测量公式采用 V( mm3 ) = ab2 /2,其中a 为长径,b < a。注射后第 36 d断颈处死裸鼠剥离肿瘤称重。
1.3 统计分析应用SPSS 10.0 统计软件进行χ2 检验。数据统计以均数± 标准差(x±s) 表示,P < 0.05 为差异有统计学意义。
2 结果 2.1 UbcH10 蛋白在转染HT-29 细胞中表达( 图 1)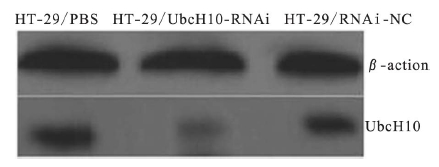 | 图 1 Western blot 分析UbcH10 蛋白在转染 HT-29 细胞中表达 |
荧光显微镜下观察转染细胞,结果显示沉默细胞系中转染的表达载体稳定表达,而且细胞生长状态良好。Western blot 检测细胞中UbcH10 蛋白表达结果表明转染pUbcH10-RNAi 表达载体的细胞HT-29 /UbcH10-RNAi 中UbcH10 表达与对照组比较 ( HT-29 /PBS 和HT-29 /RNAi-NC) 明显降低。
2.2 UbcH10 沉默对裸鼠移植性大肠癌生长抑制作用( 图 2、3)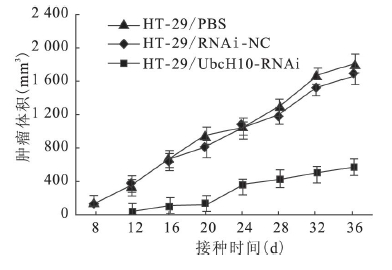 | 图 2 裸鼠肿瘤生长曲线 |
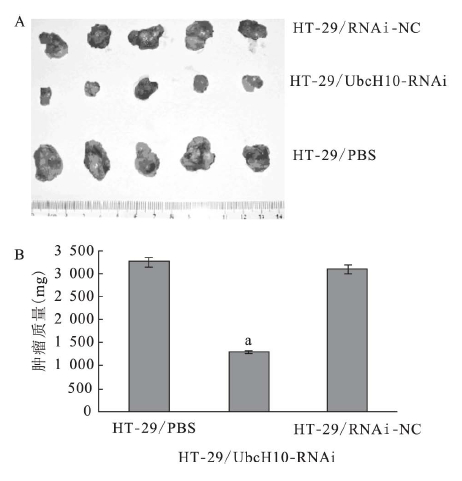 | 注: A: 各实验组对应的肿瘤照片; B: 不同组别的肿瘤质量分 析图; 与其他组比较,a P < 0. 05。图 3 UbcH10 沉默对肿瘤生长抑制作用 |
通过裸鼠移植瘤模型观察UbcH10 沉默对肿瘤发生的抑制作用。结果显示,在接种肿瘤细胞后第8 d HT-29 /PBS 组和HT-29 /RNAi-NC 组裸鼠出现肉眼可见瘤体,而HT-29 /UbcH10-RNAi 组裸鼠在接种肿瘤细胞12 d 后才隐约可见瘤体。通过描绘肿瘤生长曲线( 图 2) ,UbcH10 表达下调可抑制裸鼠移植性大肠癌的形成和生长。裸鼠接种细胞36 d 后断颈处死,剥离肿瘤并称重。HT-29 / UbcH10-RNAi 组裸鼠肿瘤大小及重量均明显低于对照组,平均为对照组的40% 左右。表明UbcH10 沉默对裸鼠移植性大肠癌的生长具有抑制作用。
3 讨论本研究成功构建的针对UbcH10 基因的RNAi 真核表达载体pUbcH10-RNAi 带有GFP 报告基因和 Kan /G418 耐受基因,属于shRNA 载体系统。该载体表达的短发夹RNA( shRNAs) 能在细胞内转变成具有siRNA 性质的短双联RNA。在构建的UbcH10 基因沉默细胞系HT-29 /UbcH10-RNAi 中,载体 pUbcH10-RNAi 稳定整合入细胞基因组中并产生了持续的基因沉默效应,为基因功能的研究提供了依据,特别是RNAi 高度的特异性以及技术流程简便、短周期、在细胞内表达的稳定性、可传递性、高效性等优势使其在肿瘤的基因治疗方面显示出应用前景。
泛素蛋白酶体系统( ubiquitin-proteasome system,UP-S) 对调控蛋白质的动态平衡起关键作用而且对调控细胞进展( 不论正常细胞还是肿瘤细胞) 起决定性作用。特异性干涉UP-S 的某一环节已被认为是一种很有前途的创新性抗肿瘤治疗方法。 UbcH10 作为E2 家族成员之一,自然也就成为肿瘤药物治疗开发的靶目标之一。Berlingieri 等[7]发现通过RNA 干扰封闭UbcH10 的蛋白质合成能抑制卵巢癌细胞株的生长,从而打开了基于UbcH10 合成和/或者功能抑制的某些卵巢癌的治疗前景。 Jiang 等[8]通过干扰途径敲除UbcH10 基因,结果发现不但能抑制胶质瘤细胞增殖,而且能通过下调 Bcl-2 促进胶质瘤细胞调亡。本研究成功建立了裸鼠移植性大肠癌模型,并且在UbcH10 基因沉默抑制大肠癌细胞增殖的基础上,在体内实验水平上证实了通过shRNA 沉默UbcH10 基因表达对大肠癌肿瘤的生长有抑制作用。因此,随着UbcH10 对肿瘤作用机制的深入研究以及从基础研究向临床应用研究的过渡,针对UbcH10 的干扰和抑制可能成为一种新型的临床分子靶点抗癌药物。
| [1] | Boyle P,Ferlay J.Cancer incidence and mortality in Europe,2004[J].Ann Oncol,2005,16:481-488. |
| [2] | 徐瑞华,邱妙珍.晚期结直肠癌化疗的研究进展[J].癌症,2008,27(6):661-666. |
| [3] | 黄甜.大肠癌患者生存时间影响因素分析[J].中国公共卫生,2008,24(1):73-74. |
| [4] | Lin Y,Hwang WC,Basavappa R.Structural and functional analysis of the human mitotic-specific ubiquitin-conjugating enzyme,UbcH10[J].J Biol Chem,2002,277(24):21913-21921. |
| [5] | Gramont A,Ganier O,Cohen-Fix O.Before and after the spindle assembly checkpoint-an APC/C point of view[J].Cell Cycle,2006,5(18):2168-2171. |
| [6] | Chen S,Chen Y,Hu C,et al.Association of clinicopathological features with UbcH10 expression in colorectal cancer[J].J Cancer Res Clin Oncol,2010,136(3):419-426. |
| [7] | Berlingieri M,Pallante P,Guida M,et al.UbcH10 expression may be a useful tool in the prognosis of ovarian carcinomas[J].Oncogene,2007,26(14):2136-2140. |
| [8] | Jiang L,Bao Y,Luo C,et al.Knockdown of ubiquitin-conjugating enzyme E2C/UbcH10 expression by RNA interference inhibits glioma cell proliferation and enhances cell apoptosis in vitro[J].Journal of Cancer Research and Clinical Oncology,2010,136(2):211-217. |
 2012, Vol. 28
2012, Vol. 28
