近年来结核分枝杆菌(Mycobacterium tuberculosis,MTB)多重耐药性(multi-drug resistance,MDR)的不断出现以及艾滋病人群对 MTB易感性的增加,导致患结核病的人数迅速增加,死亡率也在不断上升,大有死灰复燃的趋势[1],这促使科研工作者加速了新疫苗研制和新药物的开发,而与之相关的就是对结核分枝杆菌致病机理和发病机制的深入研究提出了非常紧迫的要求[2]。近年来研究证实,结核分枝杆菌的毒力与致病性与其特殊的蛋白分泌系统有关,这个分泌系统最近被命名为 VII型分泌系统或 ESX分泌系统[3]。结核分枝杆菌 ESX分泌系统包含 ESX-1,ESX-2,ESX-3,ESX-4和 ESX-5 5个相互独立的分系统,其中 ESX-1系统是结核分枝杆菌最重要的蛋白分泌系统,负责细菌入侵宿主细胞和调控机体的防御系统,与细菌的毒力密切相关,是被研究的最多的一个分泌系统[3 -4]。本文拟就各种结核分枝杆菌 EXS-1分泌蛋白与宿主细胞的相互作用进行综述,对理解结核分枝杆菌的致病机理十分重要。
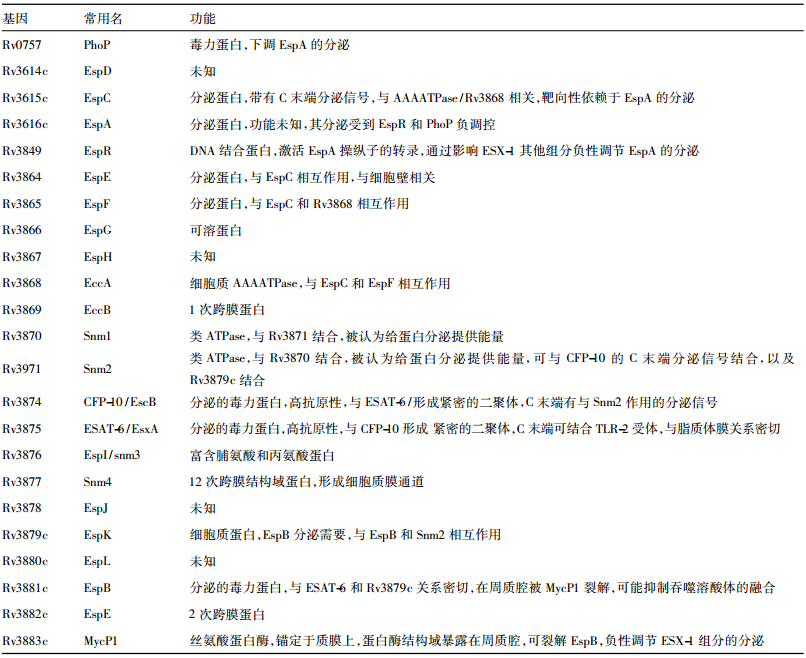
1 EXS-1系统的组成机体的免疫系统遭遇外来的病原微生物入侵后会被激活,继而消灭这些入侵物。与此相对,入侵的病原微生物也会使用种种策略躲避宿主免疫系统的攻击。在结核分枝杆菌的感染过程中,细菌进入巨噬细胞的吞噬体后不与细胞内的溶酶体融合,无法形成成熟的吞噬溶酶体,因此免遭消化降解;同时细菌还可以从巨噬细胞吞噬体中逃逸,在巨噬细胞中长期存活,并在一定时期裂解细胞,护散到其他组织细胞;感染结核分枝杆菌的巨噬细胞不易凋亡,为结核分枝杆菌的长期生存创造了条件。现已发现结核分枝杆菌的 ESX-1分泌系统可能参与了这一系列过程,并成为近年来研究热点。目前,已有多个蛋白被发现参与组成了 ESX-1分泌系统[-5](见表 1) 。其中(early secreted antigenic target of 6 kD,ESAT-6) 、 (culture filtrate protein of 10 kD CFP-10) 、 EspA、EspB、 EspC、 EspE、 EspF、 EspG、和 EspR等细菌蛋白通过特殊的机制分泌至细菌表面,参与了细菌与宿主细胞的相互作用,对细菌的毒力非常重要[-5]。
| 表 1 ESX-1 蛋白及功能 |
ESAT-6和 CFP-10是最先被发现的 2个由 ESX-1分泌系统分泌的蛋白,是结核分枝杆菌重要的毒力因子。一方面,它们是重要的 T细胞抗原,在动物模型中对结核分枝杆菌的感染有一定的保护性,是候选疫苗的重要组分,被广泛用于新型结核疫苗的设计以及用作结核的诊断抗原;另一方面,研究显示它们会影响巨噬细胞和树突状细胞的功能,与细菌的毒力相关。Guo等[6]发现,CFP-10/ESAT-6复合体预处理 ANA-1巨噬细胞后,可以活化巨噬细胞,使得由 IFN-γ诱导的 NO和 IL-12的产生随时间依赖性增强,但是换作 LPS诱导时,CFP-10/ESAT-6复合体预处理 ANA-1巨噬细胞 IL-12产生被抑制,而 NO产生不受影响。更进一步研究发现 CFP-10/ESAT-6复合体与细胞的结合虽然不依赖 IFN-γR1,却可以上调 IFN-γR1在巨噬细胞表面的表达; JAK/STAT选择性抑制剂 AG490可以减弱 NO和 IL-12的产生,这些现象说明 CFP-10/ESAT-6复合体可作为一种信号分子,激活 JAK/STAT信号通路,调节巨噬细胞的功能。但是 ESAT-6蛋白无论是单独存在还是与 CFP-10形成二聚体,均会导致巨噬细胞溶解,CFP-10单独存在时则不会有此种现象发生。在此基础上,提出 ESAT-6可能调节宿主胞膜的离子通道进而导致细胞溶解的假说,这与 Smith等人发现的结核分枝杆菌的 RD-1区相关蛋白能够使感染小鼠的肺部组织坏死相一致[5]。Ganguly等[7]发现,ESAT-6也参与到调节巨噬细胞内有丝分裂原激活蛋白(MAP)激酶途径。 ESAT-6在细胞质内参与诱导细胞外信号调节激酶 (ERK1/2)的磷酸化作用,同时 ESAT-6参与到拮抗细胞核内的脂多糖(LPS)诱导的 ERK1/2的磷酸化作用,能够下调依赖 ERK1/2的脂多糖(LPS)诱导基因 c-myc的表达。在接下来的研究中,他们还发现无论是单体蛋白 ESAT-6或 CFP-10,还是 ESAT-6和 CFP-10的二聚体均能够通过下调氧化自由基 (ROS)的水平抑制依赖 NF-κB的基因表达。
有研究发现,2~5 μg/mL的 ESAT-6浓缩液与巨噬细胞过夜孵育能够诱导巨噬细胞凋亡[8, 9]。 ESAT-6在这一浓度范围时,未在红细胞和巨噬细胞上检测到明显的膜孔形成。但是早期的研究表明纯化的 ESAT-6能够引起膜孔的形成,有助于分枝杆菌逃离吞噬液泡。可能的情况是 ESAT-6对巨噬细胞的作用存在剂量依赖性,在 2~5 μg/mL时表现出诱导细胞凋亡的活性,高于膜孔形成的临界浓度时表现为诱导膜孔形成。这个分析表明 ESAT-6可以根据不同的浓度非常戏剧化的改变它的作用方式:细胞凋亡或者膜孔形成。Basu等[10]通过双向电泳发现,重组的 CFP-10蛋白能够使 JTT4A.1细胞发生广泛的蛋白质去磷酸化,CFP-10能够下调细胞内的自由基水平进而激活细胞内的蛋白磷酸酶。这种现象表明,CFP-10蛋白能够干扰宿主细胞信号从而抑制与巨噬细胞功能相关基因的转录和翻译。同时,CFP-10蛋白能够诱导树突状细胞的成熟,CFP-10诱导成熟的树突状细胞能够造成细胞因子 IL-2和 IFN-γ分泌的明显减少,进而下调了机体对结核分枝杆菌抗原的促炎症反应。细胞因子以及趋化因子的变化在决定结核分枝杆菌感染的过程中起着重要的作用。
2.2 EspAGarces等发现 EspA分泌后以二硫键形成二聚体而发挥毒力活性。虽然抑制 EspA二硫键的形成,不会影响 EspA和其他 ESX-1分泌蛋白的分泌,也不会抑制依赖 ESX-1巨噬细胞内受体的兴奋。但是二硫键的抑制却严重减弱了结核分枝杆菌在巨噬细胞内存活的能力,以及引起鼠类疾病的能力。他们认为 EspA主要功能在于通过影响结核分枝杆菌的细胞壁完整性来调节结核分枝杆菌的毒力,敲除 EspA的突变体细胞壁完整性缺失,导致在巨噬细胞内存活能力下降[11]。
2.3 EspBEspB是 XU等在海分枝杆菌中首先发现的新的 ESX-1分泌蛋白 Mh3881c,进一步研究表明结核分枝杆菌中的同源基因 Rv3881c也由 ESX-1系统所分泌。EspB在分泌过程中的 C末端被裂解为 50 kDa和 11 kDa 2个片段,进一步研究发现 EspB的 C-末端与 ESAT-6具有直接相互作用,并且对保持 ESAT-6的细胞内水平是必需的。研究发现在分泌期间 EspB、 CFP-10和 ESAT-6的分泌是相互依赖的,对结核分枝杆菌在巨噬细胞内的生长非常重要,并且能抑制巨噬细胞吞噬体的成熟。而敲除 EspB基因的突变菌株几乎丧失毒力,EspB对毒力的贡献似乎比 CFP-10和 ESAT-6更大。有研究显示一个 CFP-10和 ESAT-6以外的 ESX-1分泌蛋白对抑制吞噬体的成熟是必需的,EspB很可能就是这个关键分子。另外 Jennifer[5]也报道了 Mh3881c与 ESAT-6可形成一个复合体,当从海分枝杆菌细胞裂解液中抽提 Mh3881c时,ESAT-6与 Mh3881c共沉淀,而在沉淀物中未检测到 CFP-10,这暗示 Mh3881c在促进 ESAT-6的膜孔形成方面可能也扮演一定角色。
2.4 EspCEspC是 RD1区外编码的 ESX-1分泌蛋白,大小和同源性类似 CFP-10和 ESAT-6。Kerry A等研究证实其包含识别 CD4 +和 CD8 +的表位,具有能够刺激 CD4 + T细胞的免疫原性,诱导 IFN-γ和 IL-2的产生,表现了同 CFP-10和 ESAT-6同等重要的免疫性质,可以作为侯选疫苗和诊断靶标。但是有关 EspC的功能和在结核分枝杆菌感染巨噬细胞过程中所起的作用未见有关报道,需要进一步研究[12]。
2.5 EspF和 EspGEspF和 EspG是 ESX-1的 2种分泌蛋白,其功能不影响 ESAT-6的表达和分泌,也不影响 ESAT-6和 CFP-10刺激 T细胞的反应。但是 Daria Bottail等研究发现这两种分泌蛋白的缺失会抑制结核分枝杆菌在 BMDMs巨噬细胞里的生长繁殖,引起结核分枝杆菌毒力的衰减,而这种不依赖 ESAT-6的毒力衰减作用表明了 EspF和 EspG可能在 ESX-1介导的致病过程中起重要作用。虽然详细的机制还未知,他们推测这些现象可能与 EspF和 EccA、 EspG和 PPE68的相互作用有关[13]。
2.6 EspREspR为一种 DNA结合蛋白,直接结合 Rv3616c-Rv3614c启动子,激活转录,活化 ESX-1分泌系统的分泌,对结核分枝杆菌的致病性非常重要。它是 DNA结合蛋白里唯一的具有反馈调节性的蛋白,调控着 ESX-1组分的转录活性,影响分泌蛋白的分泌[14]。
3 小结有研究证实,在分枝杆菌感染过程中,巨噬细胞功能的改变与 ESX-1分泌蛋白密切相关。本文集中讨论了结核分枝杆菌 ESX-1分泌蛋白与宿主巨噬细胞的相互作用,从一个方面系统探讨了结核分枝杆菌对宿主防御系统的影响。结核分枝杆菌进入宿主体内首先会被肺部巨噬细胞所吞噬,其通过改变巨噬细胞的功能,从而在细胞里面存活下来,并进一步生长繁殖,在适当时机,它又诱导细胞坏死及 IL-1β释放,使得细菌扩散并感染周围更多的细胞。另外,ESX-1分泌蛋白对宿主防御系统的调节作用也许不仅仅局限于巨噬细胞,还包括 T细胞功能,细胞因子的释放等等[15],通过一系列活动为结核分枝杆菌在体内生长繁殖营造环境。
Amanda等[16]证实由结核分枝杆菌可引起人巨噬细胞产生不依赖 caspase-1和组织蛋白酶 B的细胞坏死,但这一过程极大依赖于细菌表达的 ESAT-6存在。先前研究也报道了 ESAT-6可引起细胞溶解,这也许可用 ESAT-6剂量依赖性来解释,当 2~5 μg/mL表现出诱导细胞凋亡的活性,高于膜孔形成的临界浓度时表现为诱导膜孔形成,浓度再高时就可能引起细胞溶解死亡。Fredric等[17]在动物实验中证实 ESX-1分泌系统能够增强小鼠 IL-1β等促炎细胞因子的产生,并且这种炎性蛋白体的激活需要宿主 NLRP3和 ASC蛋白的参与。进一步的动物实验发现依赖 EXS-1分泌系统的炎性反应恶化了疾病而没有限制细菌的生长繁殖,说明这种炎性反应在分枝杆菌感染过程中对宿主是有害的,同时 NLRP3和 ASC蛋白可能对宿主来说是一个有害因素[17]。Kurenuma等证实在结核分枝杆菌感染的巨噬细胞里,编码一些 ESX-1分泌蛋白的(region of difference 1 RD1)区促进了 caspsae-1的激活,参与 IL-8和 IL-1β的产生。但这一过程是不依赖 IFN-β信号通路的,也没有 IL-6或 TNF-α的产生。进一步的实验发现,caspase-1的激活与 K +流出有关,但不依赖于 P2X7受体。由于 ESX-1分泌系统可递送一些分泌蛋白(如 ESAT-6和 CFP-10)进入宿主细胞质中,所以 caspase-1的激活可能是由 ESX-1分泌蛋白诱导的,其详细的分子机制还需要更进一步研究。有关巨噬细胞功能的改变,所有的证据都指向了 ESX-1分泌蛋白。
ESX-1分泌蛋白在发病机制中的角色仍然需要充分地来确定,但它参与了细菌对宿主细胞的入侵、改变细胞信号系统、参与了囊泡运输、吞噬体逃逸和宿主细胞溶解是无疑的。结核分枝杆菌对巨噬细胞功能的调控,也许不是某单一蛋白在起作用,而是多种 ESX-1分泌蛋白协同发挥作用,如 ESAT-6可能在细菌入侵巨噬细胞和逃逸出吞噬体液泡时起到关键作用,有利于细菌扩散和繁殖; EspB可能抑制了吞噬体成熟,使细菌在巨噬细胞内不被杀死而能够存活; CFP-10改变细胞信号通路,下调炎症反应; ESX-1分泌蛋白对 IL-1β和 IL-18细胞因子分泌的调节促进了肉芽肿的形成,这些分子事件也许都不是孤立的,而是相互依赖,相互促进,为结核分枝杆菌在宿主细胞内建立感染提供了必要条件。关于 ESX-1分泌蛋白与巨噬细胞相互作用的进一步研究将有助于促进更深一步理解分枝杆菌感染的毒力机制,对结核分枝杆菌的预防和治疗也有重要指导意义。可以预见,随着 ESX-1分泌蛋白作用机制的进一步明晰,以此为依据进行的药物开发和疫苗研制也将取得显著的进展。
| [1] | World Health Organization.Global tuberculosis control:epidemiology,strategy,financing[EB].[2009-04-13].http://www.who.int/tb/publications/global_report/2009/en/index.html. |
| [2] | Samantha L,Keith G,Angela C,et al.Extended safety and efficacy studies of a live attenuated double leucine and pantothenate auxotroph of Mycobacterium tubericulosis as a vaccine candidate[J].Vaccine,2011,29:4839-4847. |
| [3] | Wilbert B,Edith H,Daria B,et al.Systematic genetic nomenclature for type VII secretion systems[J].PLoS Pathogens,2009,5(10):e1000507. |
| [4] | Simeone R,Bottal D,Brosch R.ESX/type VII secretion systems and their role in host-pathogen interaction[J].Current Opinion in Microbology,2009,12(1):4-10. |
| [5] | Smith JA.Functional analysis of ESAT-6 and EspB,two virulence protein secreted by the ESX-1 system in Mycobacterium marinum[D].The Graduate School of the University of Maryland,2010. |
| [6] | Guo S,Bao L,Qin Z,et al.The CFP-10/ESAT-6 complex of Mycobacterium tuberculosis potentiates the activation fo murine macrophages involvement of IFN-γ signaling[J].Med Mecrobiol Immunol,2010,199:129-137. |
| [7] | Ganguly N,Giang PH,Gupta C,et al.Mycobacterium tuberculosis secretory proteins CFP-10,ESATk-6 and CFP10:ESAT-6 complex inhibit lipopolysaccharide induced NF-kB transactivation by downregulation of reactive oxidative species(ROS)production[J].Immunol Cell Biol,2008,86:98-106. |
| [8] | Derrick SC,Morris SL.The ESAT-6 oprotein Mycobacterium tuberculosis induces apoptosis of macrophages by activating caspase expression[J].Cell Microbiol,2007,9:1547-1555. |
| [9] | Smith J,Manoranjan J,Pan M,et al.Evidence for pore formation in host cell membranes by ESX-1 secreted ESAT-6 and its role in Mycobacterium tuberculosis escape form the vacuole[J].Infect Immun,2008,76(12):5478-5487. |
| [10] | Basu SK,Kumar D,Singh KD,et al.Mycobacterium tuberculosis secreted antigen(MTSA-10)modulates macrophage function by redox regulation of phosphatased[J].FEBS J,2006,273:5517-5534. |
| [11] | Alejandra G,Krishnamoban A,Michael R,et al.EspA acts as a critical mediator of ESX1-dependent virulence in Mycobacterium tuberculosis by affecting bacterial cell wass integrity[J].PLoS Pathogens,2010,6(6):e1000957. |
| [12] | Kerry A,Sarah M,Jeffrey L,et al.Rv3615c is a highly immunodominant(RD1 region of difference 1)-dependent secreted antigen specific for Mycobacterium tuberculosis infection[J].PNAS,2011,108(14):5730-5735. |
| [13] | Daria B,Laleh M,Roxane S,et al.ESAT-6 secretion-independent impact of ESX-1 genes EspF and EspG1 on virulence of Mycobacterium tuberculosis[J].Journal of Infectiions Disesases,2010,203(8):1155-1164. |
| [14] | Oren S,Cole D,Michael T,et al.EspR,a key regulatior of Mycobacterium tuberculosis virulence,adopts a unique dimeric structrure among hilix-turn-hilix proteins[J].PNAS,2011,108(33)13450-13455. |
| [15] | Relijc R,Stylianou E,Balu S,et al.Cytoline iteractions that determine the outcome of mycobacterial infection of macrophages[J].Cytokine,2010,511:42-46. |
| [16] | Amanda W,Daniel E,Olle S,et al.Human macrophages infected with a high burden of ESAT-6 expressing Mycobacterium tubercu-losis undergo caspase-1-and cathepsin B-independent necrosis[J].PLoS ONE,2011,6(5):e20302. |
| [17] | Fredric C,Janice K,Calin D.Host-detrimental role of Esx-1-mediated inflammasome activation in mycobacterial infection[J].PLoS Pathogens,2010,6(5):e1000895. |
 2012, Vol. 28
2012, Vol. 28