长期砷暴露可发展为机体多器官肿瘤,其中皮肤就是砷中毒的主要靶器官之一,因此,研究砷暴露对皮肤角质细胞的损伤作用并寻找有效的治疗手段具有重要的现实意义[1]。研究发现,叔丁基对苯二酚( tert-butylhydroquinone,tBHQ) 具有较强的细胞保护作用,可增强原代培养的人和大鼠肝细胞的抗氧化能力[2],并能有效抑制类神经元PC12 的细胞凋亡[3]。本研究选用人永生化表皮细胞HaCaT 细胞系,观察tBHQ 对无机砷致人皮肤角质细胞损伤的保护作用,为寻找针对慢性砷中毒皮肤损害的有效控制和治疗手段提供科学依据。
1 材料与方法 1.1 仪器与试剂超净工作台( 苏净集团安泰公司) ; CO2 恒温培养箱( 荷兰Heraeus 公司) ; 全自动酶标仪( 芬兰Labsystems 公司) ; 流式细胞仪( 美国 BD 公司) 。亚砷酸钠( sodium arsenite,NaAsO2 ) ( 美国Fluka 公司) ; 胰蛋白酶( 美国Hyclone 公司) ;胎牛血清( 天津市灏洋生物制品科技有限责任公司) ; 磷酸盐缓冲液、tBHQ、Alamar Blue、2',7'-二乙酰二氯荧光素( 2',7'-dichlorofluorescin diacetate,DCFH-DA) ( 美国Sigma 公司) ; 丙二醛( malon dialdehyde,MDA) 测定试剂盒( 南京凯基生物科技发展有限公司) 。
1.2 细胞系人永生化表皮细胞HaCaT 细胞系 ( 中国典型培养物保藏中心,GDC 106) 。 1.3 细胞培养和处理HaCaT 细胞株在5% CO2、 37 ℃条件下常规培养于完全培养基,隔日换液。待细胞进入对数生长期,未预处理组细胞直接加入含有0、25、50 μmol /L 的NaAsO2培养基处理24 h; 预处理组细胞经tBHQ( 25、50 μmol /L) 预处理12 h,再与NaAsO2不同浓度组共同处理24 h。
1.4 细胞活力测定参照文献[4]采用Alamar Blue 还原法进行细胞活力测定。
1.5 活性氧( reactive oxidative species,ROS) 水平测定参照文献[5]采用DCFH-DA 检测细胞内 ROS 水平。
1.6 MDA 水平测定参照试剂盒说明书采用硫代巴比妥酸( thiobarbituric acid,TBA) 法检测细胞内 MDA 的生成水平。
1.7 统计分析应用SPSS 16.0 软件进行单因素方差分析( one-way ANOVA) ,P < 0.05 为差异有统计学意义。
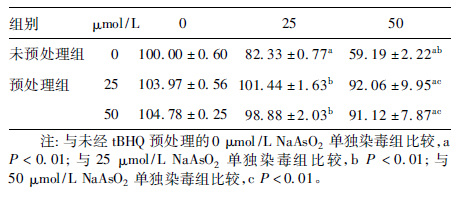
2 结果 2.1 不同NaAsO2染毒浓度组的Alamar Blue 还原率( 表 1 )| 表 1 不同NaAsO2 染毒浓度组的Alamar Blue 还原率(x ± s,n = 4,%) |
25、50 μmol /L NaAsO2单独作用于 HaCaT 细胞24 h,Alamar Blue 还原率均明显低于 0 μmol /L 组,且呈剂量- 反应关系,差异均有统计学意义( F = 379.99,P < 0.01) ; 经tBHQ 预处理12 h 后,再与不同浓度的NaAsO2共同处理,则Alamar Blue 还原率与相同浓度NaAsO2单独暴露组比较明显恢复,差异均有统计学意义( F = 175.520、25.333,P <0.01) 。而相同浓度砷暴露情况下,25和50 μmol /L tBHQ 预处理组之间的Alamar Blue 还原率无明显差异。
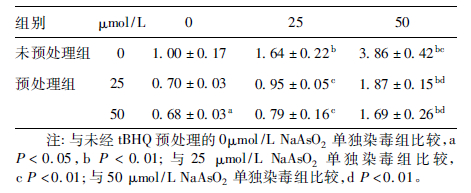
2.2 不同NaAsO2染毒浓度组的细胞内ROS 荧光强度( 表 2)| 表 2 不同NaAsO2 染毒浓度组的细胞内ROS 荧光强度(x ± s,n = 3) |
NaAsO2( 25、50 μmol /L) 单独作用于 HaCaT 细胞24 h,细胞内ROS 荧光强度明显高于 0 μmol /L 组,且呈剂量- 反应关系,差异有统计学意义( F = 79.531,P < 0.01) ; 经tBHQ 预处理12 h 后,再与不同浓度的NaAsO2共同处理,则细胞内荧光强度与相同浓度NaAsO2单独暴露组比较明显降低,差异均有统计学意义( F = 24.687、48.164,P < 0.01) 。而相同浓度砷暴露情况下,25 和50 μmol /L tBHQ 预处理组之间的细胞ROS 荧光强度无明显差异。
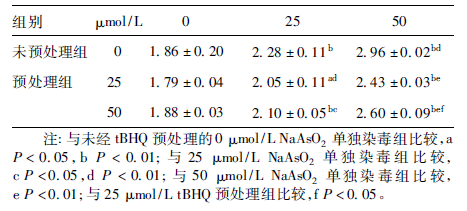
2.3 不同NaAsO2染毒浓度组的HaCaT 细胞MDA 生成情况( 表 3)| 表 3 不同NaAsO2 染毒浓度组的细胞内MDA 生成 情况[x± s,n = 3,nmol /( mg·prot) ] |
NaAsO2单独作用于HaCaT 细胞 24 h,细胞内MDA 的生成明显高于0 μmol /L 组,且呈剂量- 反应关系,差异有统计学意义( F = 51.938,P < 0.01 ) ; 经tBHQ 预处理12 h 后,再与不同浓度的NaAsO2共同处理,细胞内MDA 的生成与相同浓度NaAsO2单独暴露组比较明显降低,差异均有统计学意义( F = 4.743、 64.262,P < 0.05 或P < 0.01 ) 。且相同浓度砷暴露情况下,25 μmol /L tBHQ 预处理组细胞内 MDA 的生成水平明显低于50 μmol /L tBHQ 预处理组( F = 51.411,P < 0.05 ) 。
3 讨论本研究发现,NaAsO2单独作用HaCaT 细胞 24 h,可降低细胞活力,增加细胞内ROS 和MDA 的产量; 在给予tBHQ( 25、50 μmol /L) 预处理后,即可明显恢复这种由NaAsO2所引起的细胞损伤状况。 大量砷对皮肤角质细胞影响的体内外研究证实,无机砷能诱导人皮肤角质细胞损伤,低浓度NaAsO2 可降低HaCaT 细胞活力,引起细胞内活性氧族( reactive oxygen species,ROS) 产生,ROS 的产生可损伤脂质,并引起细胞内脂质过氧化的产物MDA 含量明显增多[6]。这些改变可进一步抑制重要的DNA 修复蛋白———多聚( ADP-核糖) 聚合酶的活性,最终导致DNA 氧化损伤加重[7]。还有研究发现,tBHQ 预处理能阻断小鼠胚胎成纤维细胞中亚砷酸钠诱导的细胞毒性和细胞凋亡,并可逆转多种无机砷诱导的基因表达[8]。本课题组前期研究也表明,tBHQ 预处理可降低Chang 肝细胞中NaAsO2导致的细胞毒性,增强细胞对NaAsO2 毒性的抵抗能力[9]。本文则就tBHQ 能否有效抑制砷引起的人皮肤角质细胞损伤进行了初步的研究。有关tBHQ 作用机制的研究初步认为,tBHQ 可能通过延缓Nrf 2 降解速率,引起胞浆Nrf 2 积累入核,稳定核中Nrf 2 不被降解[3],而使胞核Nrf 2 含量增加并激活下游靶基因的转录,有效干扰异源性有毒化合物在体内的代谢过程,并减少毒性代谢产物的生成,从而保护机体减轻损伤。综上所述,tBHQ 对无机砷致人皮肤角质细胞的损伤具有保护作用。
| [1] | 高颖,李艳华.砷对HaCaT毒作用及N-乙酰半胱氨酸拮抗作用[J].中国公共卫生,2005,21(5):587-588. |
| [2] | Keum YS,Han YH,LiewC,et al.Induction of heme oxygenase-1(HO-1)and NAD[P]H:quinone oxidoreductase 1(NQO1)by a phenolic antioxidant,butylated hydroxyanisole(BHA)and its metabolite,tert-butylhydroquinone(tBHQ)in primary-cultured human and rat hepatocytes[J].Pharm Res,2006,23(11):2586-2594. |
| [3] | Khodagholi F,Tusi SK.Stabilization of Nrf2 by tBHQ prevents LPS-induced apoptosis in differentiated PC12 cells[J].Mol Cell Biochem,2011,354(1-2):97-112. |
| [4] | 李冰,张新玉,李昕,等.无机砷的肝细胞毒性和氧化应激[J].中国工业医学杂志,2009(3):209-210. |
| [5] | Li B,Li X,Zhu B,et al.Sodium arsenite induced reactive oxygen species generation,nuclear factor(erythroid-2 related)factor 2 activation,heme oxygenase-1 expression,and glutathione elevation in Chang human hepatocytes[J].Environ Toxicol,2011,doi:10.1002/tox.20731. |
| [6] | 孙献策,王少鹏,高娜,等.砷对人皮肤角质形成细胞抗氧化能力影响[J].中国公共卫生,2009,25(8):919-920. |
| [7] | Qin XJ,Hudson LG,Liu W,et al.Dual actions involved in arsenite-induced oxidative DNA damage[J].Chem Res Toxicol,2008,21(9):1806-1813. |
| [8] | Kann S,Estes C,Reichard JF,et al.Butylhydroquinone protects cells genetically deficient in glutathione biosynthesis from arseniteinduced apoptosis without significantly changing their prooxidant status[J].Toxicol Sci,2005,87(2):365-384. |
| [9] | 朱博,李冰,张新玉,等.叔丁基对苯二酚对亚砷酸钠致Chang liver 细胞毒性的影响[J].环境与健康杂志,2009,26(8):678-679. |
 2012, Vol. 28
2012, Vol. 28