2. 中山大学公共卫生学院;
3. 广东省人民医院广东省医学科学院检验科;
4. 广东省人民医院广东省医学科学院风湿科
类风湿关节炎(rheumatoid arthritis,RA)是累及周围关节为主的多系统性炎症性自身免疫病,呈全球性分布[1]。非甾体抗炎药是其主要治疗药物,但在缓解患者症状同时伴有多种不良反应。近几十年来国外多项随机对照试验表明,补充富含二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的深海鱼油,可减少RA患者关节触痛症状、减少止痛抗炎药物的剂量[2, 3, 4]。目前,国内鲜有深海鱼油胶囊对RA患者是否具有抗炎和免疫抑制作用及是否可以减轻患者症状的相关报道。为此,本研究于2008年8月-2010年9月对经广东省人民医院风湿科诊断为RA的60例患者进行干预观察,现将结果报告如下。
1 对象与方法 1.1 对象选择2008年8月-2010年9月经广东省人民医院风湿科诊断为RA病程1~5年、年龄25~60岁的患者为研究对象。共招募124例患者,有83例患者符合调查标准,对83例患者随机分组,由电脑生成2位随机数字表,奇数分到深海鱼油组,偶数分到大豆油组,其中大豆油组44例,深海鱼油组39例,最终共60例患者完成本次研究,其中大豆油组31例,深海鱼油组29例。本课题通过广东省人民医院伦理委员会审查批准,所有患者均签署知情同意书。
1.2 纳入排除标准根据1987年国际分类标准[1]诊断RA。排除标准:确诊其他病因的关节炎及其他风湿性疾病;高脂血症、冠心病等影响血脂异常的疾病;恶性肿瘤、终末期疾病、肝肾功能异常等疾病;Steinbrocker分类Ⅳ期RA患者;怀孕及哺乳期妇女;过去3个月服用深海鱼油胶囊、维生素制剂的人群;吸烟> 10支/d;饮酒酒精> 10单位/周(1单位酒精=15 mL);中度及以上激烈运动> 3次/周;素食者;体质指数> 30 kg/m2;3个月内消费含油的鱼类膳食> 2份(共300 g生重)/周的患者。只要有其中1项符合就剔除患者。
1.3 方法 1.3.1 问卷调查及指标测量试验干预前后均调查患者一般情况、膳食摄入情况、RA临床症状、体格检查、血生化指标检测等。(1)问卷调查:采用统一的调查表以面对面访谈方式进行问卷调查。问卷包括:①基本情况:包括性别、年龄、确诊RA年限、家族疾病史、主动和被动吸烟状况、饮酒情况、既往病史。在干预开始前完成。②膳食调查:研究起始膳食调查采用食物频数问卷(food frequency questionaire,FFQ)[5]收集研究对象过去1年的饮食情况。根据《中国食物成分表 2002》[6]计算能量和营养素摄入量。③临床症状:采用自行编制问卷调查研究对象关节触痛、肿胀的位置和数量、28个关节疾病活动性评分(disease activity score in 28 joints,DAS28)[7];晨僵时间[1]及患者对自身疼痛、疲劳、总体状况的视觉模拟评分(visual analogue scale,VAS)[8]。采用健康评估问卷(health assessment questionnaire,HAQ)[9]了解RA患者生活自理情况,共20项,按0~3 4级计分。0表示毫无困难,1表示稍有困难,2表示很困难,3表示无法完成;总分越低表示患者生活自理能力越强,关节症状改善越好。在干预的0、4和12周3个时间点计算DAS28。(2)体格检查:在干预的0、4和12周3个时间点测量身高、体重、血压、心率、体质指数。(3)血生化检测:于干预开始和结束时抽取受试对象空腹12 h静脉血,检测空腹血糖(斜率法)、血沉(魏氏法)和C反应蛋白(C-reactive protein,CRP)(透射比浊法)。
1.3.2 干预过程干预时间为12周,双盲设计,干预期间深海鱼油组每人每日服用1 g/粒× 6粒深海鱼油胶囊,大豆油组每人每日服用1 g/粒× 6粒大豆油胶囊(所有对象每次2粒,随膳食一并摄入,一日3次)。干预期间指导所有对象控制饮食,即每周食用4次鱼类膳食,其中2次必须是海鱼,每次150 g生重,每天3个核桃,每人每天使用20 g调和油烹饪,以保证干预期间2组患者的膳食摄入水平处于齐同状态。干预期间每2周随访1次,发放干预胶囊,监督饮食;每3周要求对象进行3 d膳食回顾;每4周进行临床表现、体格检查、药物使用情况等回访,最后一次回访加抽血检查。3 d膳食回顾的分析根据《中国食物成分表 2002》分别计算对象的每日膳食摄入量及各种营养素的摄入量,在3 d共4次的基础上,将每个对象共12 d的膳食分析结果合计并求出平均值。期间不改变研究对象的类风湿常规治疗手段。深海鱼油胶囊和大豆油胶囊均由汕头市仙乐公司生产,经广州市质量监督局监测站检测符合本研究设计的干预剂量。
1.4 统计分析采用Epi Data 3.0软件建立数据库,所有调查问卷均经过双人重复录入数据库,应用SPSS 13.0进行统计分析。正态分布数据组内前后比较使用配对样本t检验,组间前后差值比较使用独立样本的t检验;非正态分布数据组内前后比较使用Wilcoxon检验,组间比较计算个体前后的差值进行Mann-Whitney U检验。计数资料使用χ2检验,采用单因素方差分析比较组间生化指标差异。P<0.05为差异有统计学意义。
2 结果 2.1 一般情况深海鱼油组男性13例,女性16例,平均年龄为51.83岁;大豆油组男性16例,女性15例,平均年龄为53.61岁;年龄和性别比率组间比较差异无统计学意义。深海鱼油组糖尿病3例,高血压4例,糖尿病合并高血压5例;大豆油组糖尿病2例,高血压5例,糖尿病合并高血压6例,组间比较差异无统计学意义。
2.2 不同组别患者干预前身体测量及血生化指标比较深海鱼油组、大豆油组体质指数分别为(22.72 ±3.43)、(22.93±3.41) kg/m2;心率分别为(76.07 ±1.43)、(74.94±1.59)次/min;收缩压分别为(127.62±2.26)、(123.81±2.66) mm Hg;舒张压分别为(73.97±1.95)、(75.13±1.89) mm Hg;VAS评分分别为(59.55±4.28)、(62.03±3.90)分;DAS28评分分别为(4.05±0.13)、(4.33±0.13)分;晨僵时间分别为(9.00±2.85)、(8.94±2.98) min;HAQ评分分别为(6.21±1.63)、(5.58±2.19)分;血沉分别为44(21,84.5)、25(12,77) mm/h;血糖分别为(5.76±0.31)、(5.37±0.35) mmol/L;CRP分别为13(4.02,36.8)、13.8(5.8,36.5) mg/L;干预前组间比较差异均无统计学意义。
2.3 不同组别患者干预前后多不饱和脂肪酸摄入量比较干预前,膳食频数问卷显示,2组脂肪酸摄入量比较,差异无统计学意义;干预后,2组脂肪酸摄入量比较,差异有统计学意义(P<0.05)。干预后深海鱼油组、大豆油组亚油酸(linoleic acid,LA)分别为(8.99 ±0.73)、(11.89±1.05) g;α-亚麻酸(linolenic acid,ALA)分别为(2.18±0.26)、(1.79±0.05) g;EPA分别为(1.86±0.12)、(0.07±0.12) g;DHA分别为(1.31±0.20)、(0.10±0.18) g;n-6多不饱和脂肪酸(n-6 polyunsaturated fatty acid,n-6 PUFA)分别为(9.80±1.80)、(13.20±2.69) g;n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acid,n-3 PUFA)分别为(5.81±1.99)、(2.68±1.56) g;n-6/n-3 PUFA分别为(1.76±0.34):1、(5.86±2.06):1;组间比较差异均有统计学意义(tLA=12.39,tALA=-5.82,tEPA=-56.18,tDHA=-24.68,tn-6 PUFA=5.66,tn-3 PUFA=-6.78,tn-6/n-3 PUFA=10.57,P<0.01);深海鱼油组、大豆油组干预后花生四烯酸(arachidonic acid,AA)分别为(0.04±0.04)、(0.04±0.03) g,组间比较差异无统计学意义。
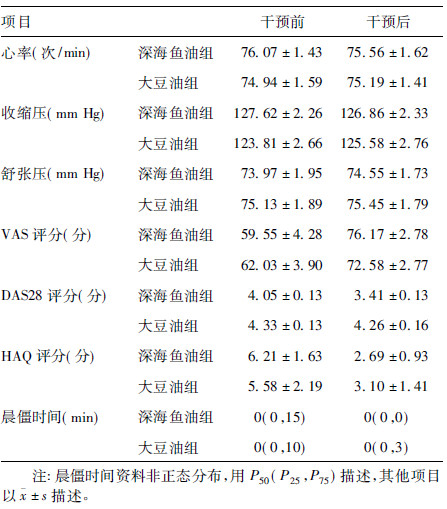
2.4 不同组别患者临床症状干预前后比较(表 1)干预后,深海鱼油组VAS评分增加值高于大豆油组,差异有统计学意义(P<0.05);干预前,2组DAS28评分均在3.2~5.1分,干预后深海鱼油组DAS28评分下降值高于大豆油组,2组差异有统计学意义(P<0.05)。2组干预前后心率、收缩压、舒张压、HAQ评分及晨僵时间差值比较,差异均无统计学意义。
| 表 1 干预前后不同组别患者临床症状 |
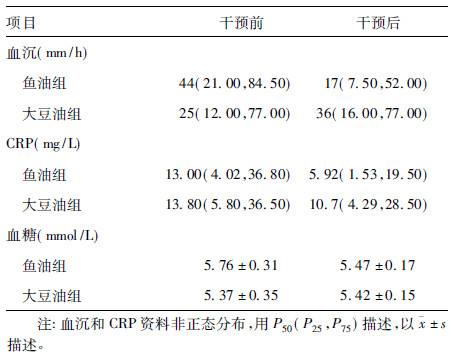
与干预前比较,干预后深海鱼油组血沉下降明显(Z=-2.836,P=0.005),大豆油组血沉上升不明显(Z=-0.360,P=0.719),2组干预前后血沉差值组间比较,差异有统计学意义(Z=313.5,P=0.044)。2组CRP差值干预前后组间差异无统计学意义(Z=387.5,P=0.359),但深海鱼油组CRP干预后比干预前下降(Z=-2.512,P=0.031),2组较大豆油组下降明显(Z=-1.029,P=0.304)。2组干预前后血糖差值组间差异无统计学意义(t=0.7,P=0.512)。
| 表 2 干预前后不同组别患者血沉CRD 和血糖 |
干预期间深海鱼油组腹泻4例,皮疹1例,未出现头痛和出血;大豆油组腹泻3例,头痛1例,皮疹1例,未出现出血症状;组间比较差异无统计学意义。
3 讨论本研究结果显示,服用深海鱼油后RA患者VAS、DAS28评分明显改善,晨僵时间有所缩短,与国外相关研究一致[2, 7]。本研究HAQ问卷结果显示,2组干预后得分均有所降低,但组间比较差异无统计学意义。分析原因可能是2组患者均进行控制饮食干预指导,与之前的基础膳食比较均有较大的改善,所以干预后2组HAQ的得分均有不同程度降低。但深海鱼油和大豆油胶囊的食用对于患者生活自理能力的自评差异无统计学意义。既往文献报道n-3 PUFAs对空腹血糖无明显作用[10],与本研究结果一致。CRP是炎症过程中出现的急性期蛋白之一,它的增高说明本病的活动性。CRP对炎症的短期改变比血沉更敏感[11]。RA患者CRP的产生与放射的进展有关[12],被公认为在确定RA患者疾病活动度方面与血沉一样有效[3]。
本研究干预期间研究对象一直予以药物治疗,每3周进行1次临床药物登记,观察发现所有患者干预期间使用的药物无变化,从临床得知,RA患者进入稳定期后所服用的药物基本维持恒定。同时本项研究的2组对象病程平均2.81年,最短3个月。血沉组间比较有统计学意义,这与相关研究结果一致[13]。Sundrarjun等[3]发现,随机、双盲、安慰剂对照的研究中,相对于安慰剂组,服用深海鱼油胶囊组CRP明显降低,组间差异有统计学意义。Babcock等[14]也得出相同的结果。本项研究中CRP组间差异无统计学意义可能与以下原因有关:干预的n-3 PUFA含量偏低;干预时间较短;人群效应,特别是广东沿海地区人群长期摄入鱼类膳食,同时试验设计时控制饮食要求2组研究对象每周摄入4次鱼类膳食使深海鱼油组患者对n-3 PUFA深海鱼油的效应不明显等。
综上所述,深海鱼油胶囊(每天1.8 g EPA+1.2 g DHA)对RA患者有一定辅助治疗效应,可改善RA患者的症状和预后。
志谢本研究是在中山大学公共卫生学院营养系苏宜香教授的指导下进行,并得到营养系张波博士、周泉博士、王萍博士的大力支持。同时还要感谢广东省人民医院广东省医学科学院营养科马文君医生、李远红医生、风湿科罗日强医生对本研究的支持,以及省医检验科黄蔚检验员的技术分析
| [1] | 董怡,叶任高,陆再英,等.内科学[M].北京:人民卫生出版社,2001:897-903. |
| [2] | Goldberg RJ,Katz J.A meta-analysis of the analgesic effects of omega-3 polyunsaturated fatty acid supplementation for inflammatory joint pain[J].Pain,2007,129:210-223. |
| [3] | Sundrarjun T,Komindr S,Archararit N,et al.Effects of n-3 fatty acids on serum interleukin-6,tumour necrosis factor-alpha and soluble tumour necrosis factor receptor p55 in active rheumatoid arthritis[J].J Int Med Res,2004,32(5):443-454. |
| [4] | Adam O,Beringer C,Kless T,et al.Antiinflammatory effects of a lowarachidonic acid diet and fish oil in patients with rheumatoid arthritis[J].Rheumatology International,2003,23(1):27-36. |
| [5] | 顾景范,杜寿玢,郭长江,等.营养调查[J].现代临床营养学,2009,6:387-392. |
| [6] | 杨月欣,王光亚,潘兴昌,等.中国食物成分表2002[M].北京:北京医科大学出版社,2002:24-325. |
| [7] | Mäkinen H,Hannonen P,Sokka T.Definitions of remission for rheumatoid arthritis and reviewof selected clinical cohorts and randomised clinical trials for the rate of remission[J].Clin Exp Rheumatol,2006,24(Suppl 43):S22-28. |
| [8] | Kanecki K,Tyszko P,Wislowska M,et al.Preliminary report on a study of health-related quality of life in patients with rheumatoid arthritis[J].Rheumatol Int,2012,doi:10.1007/s00296-012-2421-5. |
| [9] | Skoldstam L,Hagfors L,Johansson G.An experimental study of a Mediterranean diet intervention for patients with rheumatoid arthritis[J].Ann Rbeum Dis,2003,2:208-214. |
| [10] | MacLean CH,Mojica WA,Morton SC,et al.Effects of omega-3 fatty acids on lipids and glycemic control in type Ⅱ diabetes and the metabolic syndrome and on inflammatory bowel disease,rheumatoid arthritis,renal disease,systemic lupus erythematosus,and osteoporosis[J].Evid Rep Technol Assess(Summ),2004,89:1-4. |
| [11] | Van Leeuwen MA,Van Rijswijk MH,Van der Heijde DMFM,et al.The acute phase response in relation to radiographic progression in early rheumatoid arthritis:a prospective study during the first three years of the disease[J].Br J Rheumatol,1993,2(suppl 3):9-13. |
| [12] | Leeuwen MA,Rijswijk MH,Sluiter WJ,et al.Individual relationship between progression of radiological damage and the acute phase response in early rheumatoid arthritis.Towards development of a decision support system[J].J Rheumatol,1997,24(1):20-27. |
| [13] | Xue C,Liu WL,Sun YH,et al.Association between systemic inflammation and autoimmunity parameters and plasma lipid in patients with rheumatoid arthritis[J].Zhonghua Xin Xue Guan Bing Za Zhi,2011,39(10):941-945. |
| [14] | Babcock TA,Helton WS,Hong D,et al:Omega-3 fatty acid emulsion reduces LPS-stimulated macrophage TNF-alpha Production[J].Surg Infect,2002,3:145-149. |
 2012, Vol. 28
2012, Vol. 28