肺癌已成为全世界众多肿瘤中的头号杀手,其中非小细胞肺癌(non-small cell lung cancer,NSCLC) 占到肺癌总数的85%左右[1]。尽管多学科综合治疗的方法,例如像分子靶标药物、抗体与化疗药物结合等介入已介入NSCLC 的治疗并使其治疗效果有所改善,但反映患者预后情况的生存率指标仍不容乐观[2, 3]。因此,了解NSCLC 预后的影响因素对于疾病的预测、判断及治疗方式的选择都具有指导性意义。本文总结了NSCLC 的临床病理预后因素及近年与NSCLC 预后相关的分子标志物的特点,探讨不同因素与临床转归的关系,为临床治疗提供有效依据。
1 预后定义与评价预后是指预测疾病的可能病程和判断疾病的特定结局(如康复,某种症状、体征和并发症等其他异常的出现或消失及死亡) 及发生此结局的可能性,其决定了肿瘤本身的反应[4]。预后因素是指患者无论接受何种治疗均能代表其临床转归的特征,其中转归即对治疗的反应或治疗后的生存获益情况[5]。评价预后主要是根据试验或调查得到的数据,利用统计学的方法进行处理后对生物或人的生存时间进行统计分析,研究生存时间和结局与众多影响因素间关系及其程度大小。现今多采用COX 回归因素分析的方法来分析影响生存的危险因素。 有些研究利用预后指数对疾病进行预测,为临床治疗计划提供有价值的参考[6]。
2 临床病理因素与NSCLC 预后研究发现很多临床病理因素与NSCLC 的预后相关,例如: TNM 分期、淋巴结转移情况、贫血等成为NSCLC 的独立预后因素,另外,如性别、吸烟与否、年龄、体重等因素也会影响患者的生存率[7]。
2.1 TNM 分期肺癌TNM 分期主要根据肿瘤大小(tumor,T) 、淋巴结转移情况(nodal,N) 、是否具有远处转移性(metastasis,M) 对肺癌进行分期,将具有相同预后又能实施同一治疗策略的TNM 组合划分同一期,并根据此分期较早确定原发灶大小、病变范围和有无远处器官转移,从而选择相应的治疗方式[7]。Chansky 等[8]研究发现T、N、M 3 期可分别作为独立的预后影响因素。对T 分期因素而言,肿瘤直径大小(大多以3 cm 为界) 与预后密切相关,肿块直径> 5 cm 是肺癌不良的预后因素; 对N 分期因素而言,淋巴结受累的站点、站数均与预后密切相关,淋巴结转移复杂程度也与肺癌恶性程度呈正比,与肿瘤预后呈负相关; 对M 分期因素而言,受累的脏器越多,提示预后不良。
2.2 贫 血肿瘤相关性贫血又称癌性贫血是由于恶性肿瘤本身和相关治疗所导致的贫血,是恶性肿瘤患者常见的并发症之一,恶性肿瘤患者癌性贫血发生率高达50%。贫血可导致肿瘤组织缺氧,通过改变肿瘤细胞的基因表达进而引起其蛋白质组的改变,增强肿瘤的侵袭能力,不但促进了肿瘤的发展和转移,而且也增强了肿瘤对放疗化疗的抵抗力,从而影响肿瘤患者的治疗效果,降低患者的生存率,影响预后[9]。Xu 等[10]研究发现NSCLC 患者的贫血发生率由化疗前的47.1%上升为78.6%,而且伴随着贫血的发生,NSCLC 患者的生存治疗明显下降,降低患者的认知能力,成为影响NSCLC 患者预后的又一独立因素。
3 分子标志物与NSCLC 预后除临床预后相关指征外,现今越来越倾向于通过肿瘤分子标志物的相关指征分析其与预后的相关性。临床上同一标志物可用不同方法进行检测,按照临床中对肿瘤标志物检测方法的不同,肿瘤分子标志物主要分为血清学水平和组织学水平肿瘤标志物2 种类型。
3.1 血清学水平标志物临床上检测肿瘤应用较为广泛的血清学标志物主要有癌胚抗(carcino-embryonic antigen,CEA) 、神经元特异性烯醇化酶(neu-ron-specific enolase,NSE) 等。随着肿瘤标志物研究的不断发展,对于细胞角蛋白19 片段(CYFRA21-1) 、人类类几丁质酶蛋白1(YKL-40) 、雌激素(estrogen) 及雌性激素受体(estrogen receptors,ERs) 的研究也越来越广泛,这些因素有待于发展为新型标志物应用于临床预后评估。
3.1.1 细胞角蛋白19 片段(cytokeratin 21 fragment,CYFRA21-1)细胞角蛋白(cytokeratin,CK) 属于中微丝(interone-diate filament) 蛋白家族,属于上皮细胞骨架的一部分,根据氨基酸序列的不同将角蛋白分为20 种,分别为CK1-20,其中CYFRA21-1 为 CK-19 片段,是一种酸性细胞蛋白。一般情况下整分子的细胞角蛋白呈难溶状态存在,但在肺癌患者血清中由于肿瘤坏死和细胞溶解使得CYFRA21-1 以酸性亚单位的形式释放到血液中,从而可作为NSCLC 特异性标志物应用于临床诊断[11]。Xu 等[12]人对112 例NSCLC 患者化疗前后血清CYFRA21-1 水平通过化学发光法分析后得知,血清CYFRA21-1 水平下降 ≥60%的患者生存期为12.3 个月,明显长于CYFRA21-1 水平下降< 60% 患者8.9 个月的生存期 (P < 0.001) 。Xu 等[12] 研究者还发现血清 CYFRA21-1水平能够敏感地反映肿瘤体积大小的变化,而且也可作为预测预后生存期的可信指标。
3.1.2 人类类几丁质酶蛋白1(YKL-40)YKL-40 是一种不具有壳多糖分解活性的炎症分泌型蛋白,其大小约为40 kDa,主要由癌细胞和肿瘤相关巨噬细胞产生。YKL-40 的基因CHI3L1 位于染色体 1q32.1 位置。研究表明YKL-40 可作为血管形成的促进因子在肿瘤中出现,阻断血管内皮生长因子 (VEGF) 可使YKL-40 的表达量急剧增加。在肿瘤发生过程中的另一个影响因子表皮生长因子受体的增殖也能够抑制YKL-40 的表达,与其呈负相关[13]。 在近期的研究中发现,YKL-40 可成为NSCLC 的独立预后标志物。Thom 等[14]对189 例患者的研究也发现NSCLC 患者血清中YKL-40 的中值为209 ng / mL(范围19 ~ 2 153 ng /mL) ,表达量高于中值的患者生存时间为32 周,远远低于表达量低于中值的患者41 周的生存期(P = 0.007) ,预后较差。因此,血清中YKL-40 的高水平表达提示其可作为NSCLC 预后不良的指标之一,但具体临床指标还有待于进一步研究来确定。
3.2 组织学标志物肿瘤组织学标志物主要是利用免疫组化和原位分子杂交组化技术对肿瘤分期及预后进行判断和评估。而导致这类NSCLC 标志物产生的主要原因又可大致归为信号转导、DNA 损伤修复、生长因子及受体等的失调以及癌症相关基因突变等及其他一些未归类的原因。这几类组织学肿瘤标志物对于NSCLC 的预后及临床转归都具有重要意义。
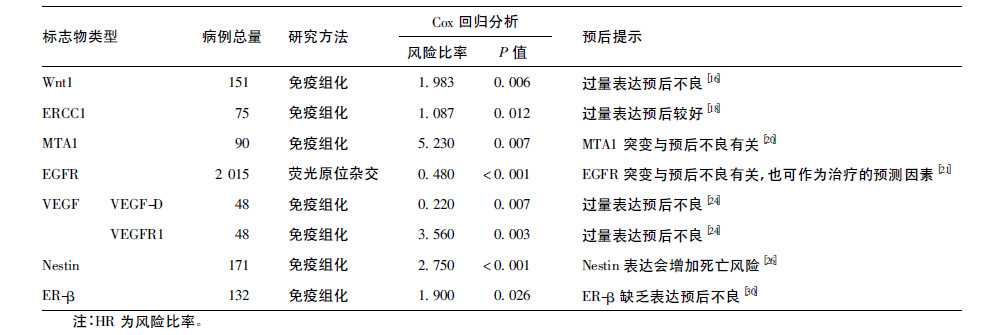
3.2.1 Wnt 信号通路-Wnt1 蛋白Wnt1 蛋白是 Wnt 信号传导通路中第一个发现的蛋白。Wnt 信号通路在进化上高度保守,并且是一种对控制胚胎发育有重要作用的信号转导通路。通过对Wnt 基因家族成员编码产物及生物学效应的研究发现,Wnt 信号通路的激活异常可参与多种人类癌症的发生[15]。NSCLC 中有关Wnt 信号通路的研究相对较少,Nakashima 等[16]研究发现,151 例NSCLC 患者中 40.4%呈现Wnt1 阳性,而且Wnt1 阳性患者的生存情况明显低于阴性患者(P = 0.0003,差异极显著) 。 Cox 回归分析显示Wnt1 的表达可以作为NSCLC 预后因素之一(HR= 1.983,P = 0.0061) 。
3.2.2 DNA 损伤修复-切除修复交叉互补基因1 (ERCC1)核苷酸切除修复交叉互补(excision repair cross-complementing,ERCC) 基因家族主要通过核苷酸进行切除和修复来减少DNA 的损伤。其在维持基因组功能完整性、修复致癌因素所导致的损伤及抗癌过程中起到至关重要的作用。切除修复交叉互补基因1(ERCC1) 是DNA 修复系统中的一个关键基因,此基因可编码一个含有297 个氨基酸的蛋白质,其与恶性肿瘤的发生、预后及治疗反应等关系密切[17]。Wang 等[18] 在对其所收集的75 例 NSCLC 患者进行免疫组化测定后发现,化疗或放疗后ERCC1 的表达与患者预后呈正相关,Ⅰ期ERCC1 高表达患者较低表达患者生存时间长,前者生存时间为72.00 个月,而后者为64.67 个月(P = 0.0327) ,Cox 多因素分析显示ERCC1 高表达是 NSCLC 患者预后较好(P = 0.012) 。总体来说 ECRR1 的表达量高低可以作为判断NSCLC 患者独立预后的候选因素之一。
3.2.3 癌症相关基因-转移相关蛋白-1(metastasis-associated protein 1,MTA1 蛋白)转移相关基因1 是近期被发现的转移相关基因候选人之一,它编码一个由715 个氨基酸残基组成的MTA1 蛋白,其预测分子量为82 kDa。MTA1 基因发生突变可以改变细胞角蛋白细丝系统,增强细胞的侵袭转移能力,从而对肿瘤的生长产生影响[19]。较多的科学研究主要集中在MTA1 蛋白与人类肿瘤侵袭转移能力上,关于MTA1 表达与肺癌关系的研究近期才有报道。Yu 等[20]通过对90 例NSCLC 患者的综合分析发现,MTA1 蛋白过量表达的患者5 年存活率为 40.9%,远远小于MTA1 蛋白不表达的患者84.1% 的5 年存活率。Cox 回归分析证实MTA1 蛋白的表达可以作为判断NSCLC 的独立预后因素(HR= 5.23,P = 0.007) ,但还需进一步的研究才能真正应用于临床[20]。
3.2.4 生长因子类(1) 表皮生长因子受体(epidermal growth factor receptor,EGFR) : 表皮生长因子受体是一种在所有表皮和基质细胞中均有表达的跨膜糖蛋白,此跨膜蛋白具有3 个功能结构域: 一个包含2 个EGF 结合位点的胞外结构域; 一个疏水的跨膜结构域和一个胞质结构域(酪氨酸激酶(TK) 和羧基自身磷酸化区域) 。EGFR 信号通路对细胞的生长、增殖和分化等生理过程发挥重要作用。EGFR 结构域中的受体酪氨酸激酶的调节紊乱可导致细胞的恶性增殖和转移,细胞死亡的延迟或者血管的诱导生成,引起肿瘤的发生[21]。Rossi 等[22]对2 015 例NSCLC 患者进行EGFR 基因突变研究后发现,这 2 015 例患者中EGFR 突变患者有350 例(16.6%) 。 在EGFR 突变呈阳性的患者中女性占69.7%,无吸烟史的患者占66.6%,患有恶性肿瘤的占80.9% (所有的对比中,P < 0.001) 。另外,在261 例EGFR 突变阳性的患者中,利用药物吉非替尼治疗的患者生存期明显高于接受卡铂治疗的患者(HR= 0.48,95%CI = 0.36 ~ 0.64,P < 0.001) 。此研究提示EGFR 突变可作为判断生存预后及治疗的阳性因素。 (2) 血管内皮生长因子(VEGF) : 血管内皮生长因子 (vascular endothelial growth factor,VEGF) 是内皮细胞生长中的有力生长因子,它的表达是在组织缺氧和一些不同的生长因子和细胞因子的刺激下产生。 VEGF 结合其受体VEGFR-1 和VEGFR-2 及较少的 VEGFR-3 来调节内皮细胞的增殖,转移并促进血管的生成。VEGF 也可以增强血管的渗透性,参与血液凝结、纤维蛋白溶解以及细胞凋亡等通路。VEGF 的过量表达是NSCLC 血管生成过程中的重要原因[23]。Pau 等[24]也对VEGF 及其受体进行了相应研究,其研究发现VEGF-B,VEGF-D 及VEGFR1 表达阳性的患者生存期明显低于阴性患者,其P 值分别为0.007、0.02、0.007。综合以上学者的研究不难看出,VEGF 家族中的成员对于NSCLC 的预后具有重要意义,但目前的研究仅限于其中的部分成员,对于VEGF 家族各个成员的预后研究价值的精确判断还未定论。
3.2.5 神经巢蛋白(nestin)神经巢蛋白属于中间丝状体蛋白Ⅵ家族的一员,它在中枢神经系统形成过程中由祖细胞或者干细胞所特异性表达。nestin 作为重要的细胞因子参与调控细胞的增殖,生存和分化,它主要在中枢神经系统和肌原组织形成的初级阶段表达,待到组织成熟其表达量也随之下降[25]。然而在肿瘤形成阶段nestin 的表达量会再次有所增加。有关nestin 在上皮肿瘤例如胰腺癌、 乳腺癌等中的报道相对较多,但有关其与NSCLC 的研究也是最近几年才渐渐增多。Ryuge 等[26]近期对171 名NSCLC 患者的研究后也发现,nestin 在27 名患者中表达,而且只存在细胞质表达。而且nestin 的表达显著伴随有鳞状细胞癌(P = 0.001) 、淋巴结转移(P = 0.008) 、瘤内血管侵袭(P = 0.003) 、 瘤内淋巴管侵袭(P = 0.008) 、胸膜侵袭(P = 0.039) 和较差预后(P < 0.001) 。多变量分析后发现同其他临床病理因子相比,nestin 的表达会增加死亡风险(HR= 2.75; 95% CI = 1.39 ~ 5.46,P < 0.001) 。2 种研究均表明nestin 的表达是 NSCLC 术后患者低生存率的一个潜在独立预后因素之一。
| 表 1 组织学标志物与预后研究总结 |
雌激素是一种女性激素,由卵巢和胎盘产生,肾上腺皮质也产生少数雌激素。雌激素受体是核受体超家族成员之一,其包括2 个亚型: ER-α 和ER-β,主要介导雌激素的多向效应,不仅在多种发育和生理过程中起着广泛的作用,也在多种肿瘤发生发展过程中其中重要作用[27]。在近期的研究中发现,血清中的雌激素水平及雌激素受体均可作为NSCLC 的独立预后因素。Susan 等[28]人对 815 例NSCLC 患者研究后发现,患者血清中雌激素含量较高时生存情况很不乐观(P < 0.001,差异极显著) ,相反血清雌激素的低含量有助于改善患者的生存情况。另外,科学家们对ER-α 和ER-β 的研究也发现,ER-α 的等位基因多态性可以与增加其表达量有关,会导致患者较低的生存率。然而,ER-β 的缺乏与患者的低生存率相关[29]。Kawai 等[30]对 132 例NSCLC 患者进行免疫组化后发现,73% 的患者细胞质中发现ER-α 的表达,51% 的患者细胞核中发现ER-β 的表达。而且ER-α 的表达与低生存率相关(P < 0.001) ,ER-β 的表达缺乏也同样与低生存率相关(P = 0.028) 。但经多因素Cox 分析后发现ER-β 的缺乏更能作为预后不良的独立因素 (HR= 1.9,95% CI = 1.1 ~ 3.4; P = 0.0264) 。由此可见,ER,ER-α,ER-β 三者均可作为NSCLC 患者预后的指标,对于它们与NSCLC 预后的关系还需进一步研究来证实。
4 小 结肺癌的预后因素较为复杂,对于肺癌预后相关因素的研究也在不断更新,但TNM 分期一直是临床上重要的预后因素之一。随着2009 年恶性肿瘤 TNM 分类的第7 次更新,对于准确预测患者生存期以及指导临床治疗都有相当大的帮助。近些年研究肿瘤的学者增加,对于肿瘤相关血清学和组织学分子标志物的发现也层出不穷,但对这些标志物临床预后领域的研究却有些匮乏,真正能够应用于临床分析的标志物更少之又少。因此,基础医学与临床应用之间的鸿沟也有待于通过进一步的研究来解决。
| [1] | Molina JR,Yang P,Cassivi Sd,et al.Non-small cell lung cancer: epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin Proc,2008:83(5):584-594. |
| [2] | Winton T,Livingston R,Johnson D,et al.Vinorelbine plus cisplatin vs observation in resected non-small-cell lung cancer[J].N Engl J Med,2005,325:2589. |
| [3] | Lee ES,Son DS,Kim SH,et al.Prediction of recurrence-free survival in postoperative non-small cell lung cancer patients by using an integrated model of clinical information and gene expression[J].Clin Cancer Res,2008,14(22):7397-7404. |
| [4] | 董碧蓉.疾病预后判断的循证[J].中华医学杂志,2001,12: 65-67. |
| [5] | 马丽,韩晓红,石远凯.非小细胞肺癌中预测疗效和评价预后的分子标志物研究进展[J].癌症进展,2010,8(3):223241. |
| [6] | 余红梅,何大卫.预后指数在慢性病及肿瘤病人长期生存预测中的应用[J].中国公共卫生,2001,17(8):749-750. |
| [7] | Bryan J,Schneider.Non-small cell lung cancer staging:proposed revisions to the TNM system[J].Cancer Imaging,2008,8: 181-185. |
| [8] | Chansky K,Sculier JP,Crowley JJ,et al.The international association for the study of lung cancer staging project:prognostic factors and pathological TNM stage in surgically managed non-small cell lung cancer[J].J Thorac Oncol,2009,4(7):792-801. |
| [9] | Vaupel P,Mayer A,Briest S,et al.Oxygenation gain factor:a novel parameter characterizing the association between hemoglobin level and the oxygenation status of breast cancers[J].Cancer Res, 2003,63(22):7634-7637. |
| [10] | Xu C,Gao X,Li L,et al.Impact of anemia on chemotherapy efficacy and prognosis in patients with advanced non-small cell lung cancer[J].Chin J Lung Cancer,2010,13(10):968-974. |
| [11] | Muraki M,Tohda Y,Iwanaga T,et al.Assessment of serum CYFRA21-1 in lung cancer[J].Cancer,1996,77(7):1274. |
| [12] | Xu C,Liu JL,Xing LL,et al.Clinical significance of serum cytokeratin 19 fragment in the prediction of chemotherapy efficacy and prognosis in patients with advanced non-small cell lung cancer[J].Chin J Lung Cancer,2010,13(10):954-961. |
| [13] | Horbinski C,Wang G,Clayton A.YKL-40 is directly produced by tumor cells and is inversely linked to EGFR in glilblastomas[J]. Int J Clin Exp Pathol,2010,3(3):226-237. |
| [14] | Thm I,Andritzky B,Schuch G,et al.Elevated pretreatment serum concentration of YKL-40-an independent prognostic biomarker for poor survival in patients with metastatic non small cell lung cancer[J].Cancer,2010,116:4114-4121. |
| [15] | Klaus A,Birchemeier W.Wnt signalling and its impact on development and cancer[J].Nat Rev Cancer,2008,8(5):387-398. |
| [16] | Nakashima T,Liu D,Nakano J,et al.Wnt1 overexpression associated with tumor proliferation and a poor prognosis in non-small cell lung cancer patients[J].Oncol Rep,2008,19(1):203209. |
| [17] | Xu C,Fend D,Li L,et al.The expression and prognostic significance of ERCC1 and GST-pi in lung cancer[J].Chin Lung Cancer,2010(13):195-200. |
| [18] | Wang HM,Feng JX,Zhang XY,et al.Prognostic analysis of ERCC1,RRM1 and p53 expressions in postoperative stageⅠ-Ⅱ lung cancer[J].Chin J Lung Cancer,2009,12:387-395. |
| [19] | Hofer MD,Menke A,Genze F,et al.Expression of MTA1 promotes motility and invasiveness of PANC1 pancreatic carcinoma cells[J].Br J Cancer,2004,90:455-462. |
| [20] | Yu Y,Wang Z,Zhang MY.Relation between prognosis and expression of metastasis-associated protein 1 in stage I non-small cell lung cancer[J].Interactive Cardio Vascular and Thoracic Surgerg,2011,12:166-169. |
| [21] | Al-haddad S,Zhang Z,Leygue E,et al.Critical update and emerging trends in epidermal growth factor receptor targeting in cancer[J].J Clin Oncol 2005,23:2445-2459. |
| [22] | Rossi A,Galetta D,Gridelli C.Biological prognostic and predictive factors in lung cancer[J].Oncology,2009,77:90-96. |
| [23] | Singhal S,Vachani A,Antin-Ozerkis D,et al.Prognostic implications of cell cycle,apoptosis,and angiogenesis biomarkers in nonsmall cell lung cancer:a review[J].Clin Cancer Res,2005,1 (11):3974-3986. |
| [24] | Carrillo de Santa Pau E,Arias FC,Caso Pela'ez E,et al.Prognostic significance of the expression of vascular endothelial growth factors A,B,C,and D and their receptors R1,R2,and R3 in patients with non small cell lung cancer[J].Cancer,2009,4:1701-1712. |
| [25] | Sejersen T,Lendahl U.Transient expression of the intermediate filament nestin during skeletal muscle development[J].J Cell Sci,1993,106(Pt 4):1291-1300. |
| [26] | Ryuge S,Sato Y,Wang GQ,et al.Prognostic significance of nestin expression in resected non-small cell lung cancer[J].Chest, 2010,9(Epub ahead of print).[27] Boqush TA,Dudko EA,Beme AA,et al.Estrogen receptor expression in tumors diferent from breast cancer[J].Antibiot Khimioter,2009,54(7-8):41-49. |
| [27] | Susan E,Olivo-Marston,Leah E,et al.Serum estrogen and tumorpositive estrogen receptor-alpha are strong prognosis classifiers of non-small-cell lung cancer survival in both men and women[J]. Carcinogenesis,2010,31(10):1778-1786. |
| [28] | Mauro LV,Dalurzo M,Carlini MJ,et al.Estrogen receptorβand epidermal growth factor receptor as early-stage prognostic biomarkers of non-small cell lung cancer[J].Oncol Rep,2010,24(5): 1331-1338. |
| [29] | Kawai H,Ishii A,Washiya K,et al.Estrogen receptorαandβare prognostic factors in non-snall cell lung cancer[J].Clin Cancer Res,2005,11(14):5084-5089. |
 2012, Vol. 28
2012, Vol. 28