汞在自然界有三种存在形式: 元素汞、无机汞和有机汞,其中以甲基汞(methylmercury,MeHg) 的神经毒性最为严重[1]。过量生成的活性氧簇(reactive oxygen species,ROS) 与甲基汞神经毒性有密切关系[2]。Ca2 + 是甲基汞所致神经毒性的关键因子,ROS 与Ca2 + 可以相互作用,二者共同诱导神经毒性的发生[3, 4]。茶多酚(tea polyphenols,TP) 是天然抗氧化剂,可有效清除人体内活性氧自由基[5]。本研究通过观察茶多酚对甲基汞中毒引起的大脑皮质 Na + -K + -ATP 酶、Ca2 + -ATP 酶活力,Ca2 +、ROS 含量及细胞凋亡变化的影响,探讨甲基汞致神经毒性的机制及茶多酚的保护作用。
1 材料与方法 1.1 主要仪器与试剂高速分散均质机(上海标本模型厂) ; KS-150 型超声波细胞破碎机(宁波科生仪器厂) ; 2-16K 低温超速离心机(美国Sigma 公司) ; 722 分光光度计(上海第三分析仪器厂) ; FACSCAN 流式细胞仪(美国Becton Dickison 公司) ; F-4500 荧光分光光度计(日本HICATHI 公司) ; 氯化甲基汞(CH3HgCl,纯度97%,德国Dr-Ehrenstorfer 公司) ; 茶多酚(长沙蓝威生物制品有限公司) ; DCFH-DA 荧光染料、Fura-2 /AM 荧光染料(美国Sigma 公司) ; 细胞凋亡测试盒(南京凯基生物科技发展有限公司) 。
1.2 动物分组及染毒健康成年清洁级Wistar 大鼠(中国医科大学实验动物中心) 36 只,体重(180 ± 10) g,雌雄各半。许可证号: SYXK (辽) 2003-0013。正式实验前适应性饲养7 d,按体重随机分成 3 组,每组12 只。对照组,染汞组,茶多酚干预组。 前2 组空腹以大豆油灌胃,茶多酚干预组空腹灌胃 1 mmol /kg 茶多酚; 2 h 后,对照组腹腔注射生理盐水,染毒组与茶多酚组同时腹腔注射12 μmol /kg CH3HgCl。干预隔日1 次,染毒每日1 次,连续干预与染毒4 周。干预与染毒容量均为5 mL /kg。
1.3 样品采集及处理最后1 次染毒后24 h,各组取8 只大鼠,乙醚麻醉后处死,断头取出完整大脑,冰浴下切取大脑皮质,制备5% 匀浆液待用; 各组其余4 只大鼠,操作相同,制备单细胞悬液待用。
1.4 指标测定及方法Na + -K + -ATP 酶及Ca2 + -ATP 酶活力的测定采用硫酸亚铁钼磷蓝定磷法[6]; 细胞内Ca2 +、ROS 含量及细胞凋亡情况的测定应用流式细胞仪; 蛋白含量的测定采用Lowry 法[7]。
1.5 统计分析实验数据以x±s 表示。采用 SPSS 11.5 软件进行统计学分析,采用单因素方差分析进行组间差异的显著性检验,两组间比较用 LSD-t 检验(least-significant difference t-test) 。当 P < 0.05 时,为差异有统计学意义。
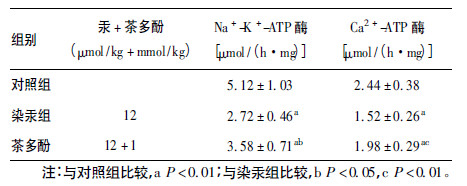
2 结果 2.1 不同组别大鼠大脑皮质Na + -K + -ATP 酶及 Ca2 + -ATP 酶活力(表 1)| 表 1 各组大鼠大脑皮质Na + -K + -ATP 酶及 Ca2 + -ATP 酶活力(x±s,n = 8) |
与对照组比较,染汞组大鼠大脑皮质Na + -K + -ATP 酶及Ca2 + -ATP 酶活力明显降低(t = 6.007、5.668,P < 0.01) ; 与染汞组比较,茶多酚干预组大鼠大脑皮质Na + -K + -ATP 酶、 Ca2 + -ATP 酶活力明显升高(t = 2.865、3.294,P < 0.05 或P < 0.01) 。
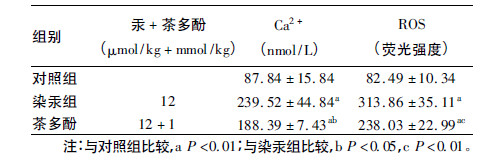
2.2 不同组别大鼠大脑皮质细胞内Ca2 + 及ROS 含量(表 2)| 表 2 各组大鼠大脑皮质细胞Ca2 + 及ROS 含量(x±s,n = 4) |
与对照组比较,染汞组大鼠大脑皮质细胞内Ca2 + 及ROS 含量(用平均荧光强度表示) 明显升高(t =6.380、12.644,P < 0.01) ; 与染汞组比较,茶多酚干预组大鼠大脑皮质细胞内Ca2 +、ROS 含量明显降低(t =2.250、3.614,P <0.05 或P <0.01) 。
2.3 不同组别大鼠大脑皮质的细胞凋亡率给予大鼠干预与染毒4 周后,与对照组[(3.27 ± 1.09) %]比较,染汞组大鼠大脑皮质细胞凋亡率 [(40.84 ± 6.26) %]明显升高(t = 11.834,P < 0.01) ; 与染汞组比较,茶多酚干预组大鼠大脑皮质细胞凋亡率[(28.31 ± 4.34) %]明显降低(t = 3.292,P < 0.01) 。
3 讨 论谷氨酸(glutamate,Glu) 是中枢神经系统具有代表性的兴奋性氨基酸[8],正常情况下,神经元和胶质细胞之间的谷氨酸处于动态平衡状态。当谷氨酸释放增加,胶质细胞重摄取功能下降时,就会导致兴奋性毒性。谷氨酸作用于细胞膜上的N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA) 受体,升高细胞内 Ca2 + 浓度,造成钙超载,最终导致细胞死亡[9, 10]。
兴奋性毒性与氧化损伤相互联系,兴奋性毒性可引起ROS 生成增加; 氧化损伤也可以加剧兴奋性毒性[11]。神经细胞过度兴奋导致胞内Ca2 + 浓度升高,可通过一系列途径增加ROS 生成; 反过来,ROS 可通过动员线粒体内Ca2 + 释放,增加胞浆游离的 Ca2 + 水平而加剧兴奋性毒性,最终激活核酸内切酶,导致DNA 双链破坏从而诱发细胞凋亡[12]。
茶多酚是天然抗氧化剂,能有效清除自由基,抑制过氧化反应[13]。本实验通过预先给予大鼠茶多酚后再染汞,发现大脑皮质细胞内ROS 含量明显降低,Ca2 + 含量明显降低,表明茶多酚可能通过对自由基的清除,同时改善细胞内钙超载,从而减轻细胞凋亡。因此,茶多酚对甲基汞所致的神经毒性具有一定的保护作用。
| [1] | Limke TL,Atchison WD.Acute exposure to methylmercury opens the mitochondrial permeability transition pore in rat cerebellar granule cells[J].Toxicol Appl Pharmacol,2002,178:52-61. |
| [2] | Amonpatumrat S,Sakurai H,Wiriyasermkul P,et al.L-glutamate enhances methylmercury toxicity by synergistically increasing oxidative stress[J].Pharmacol Sci,2008,108(3):280-289. |
| [3] | Amoreaux WJ,Marsillo A,Idrissi A.Pharmacological characterization of GABAA receptors in taurine-fed mice[J].Biomed Sci,2010,17(1):14. |
| [4] | 王岳飞,徐平,李磊,等.茶多酚与几种天然抗氧化物质的协同作用研究[J].茶叶科学,2010,30(2):109-114. |
| [5] | 陈传义,彭仁绣,李元涛.七氟醚麻醉对大鼠脑ATP酶的动态影响[J].中华实验外科杂志,2004,8:972-974. |
| [6] | 杨建雄.生物化学与分子生物学实验技术教程[M].北京:科学出版社,2002:36. |
| [7] | Tsurugizawa T,Torii K.Physiological roles of glutamate signaling in gut and brain function[J].Bio Pharm Bull,2010,33(11): 1796-1799. |
| [8] | Luo Y,Good CH,Diaz-Ruiz O,et al.NMDA receptors on non-dopaminergic neurons in the VTA support cocaine sensitization[J]. PLoS One,2010,5(8):e12141. |
| [9] | Avshalumov MV,Rice ME.NMDA receptor activation mediates hydrogen peroxide-induced pathophysiology in rat hippocampal slices[J].Neurophysiol,2002,87:2896-2903. |
| [10] | Amonpatumrat S,Sakurai H,Wiriyasermkul P,et al.L-glutamate enhances methylmercury toxicity by synergistically increasing oxidative stress[J].Pharmacol Sci,2008,108(3):280-289. |
| [11] | 徐新云,丁利平,李学余,等.氯化镉对NRK肾细胞DNA损伤及细胞凋亡作用[J].中国公共卫生,2009,25(10):12401241. |
| [12] | Fukasawa R,Kanda A,Hara S.Anti-oxidative effects of rooibos tea extract on autoxidation and thermal oxidation of lipids[J]. Oleo Sci,2009,58(6):275-283. |
 2012, Vol. 28
2012, Vol. 28