肉毒神经毒素(botulinum neurotoxin,BoNT) 是由肉毒梭 菌分泌的毒性最强的蛋白质,引起人中毒的主要为A 型,可 用于生物武器。近年来,肉毒中毒在世界各地时有发生,特别 是“9·11”事件之后,肉毒毒素成为各国生物反恐的重要内 容。建立一种快速、灵敏、可靠的肉毒梭菌检测方法,对于生 物防护和食品安全具有重要意义〔1〕。目前,肉毒梭菌的常规 检测方法主要包括毒素蛋白检测和PCR 基因检测等 〔2, 3〕。 本研究以A 型肉毒神经毒素基因(botulinum neurotoxin type A,atx) 为靶基因,建立一种灵敏度高、特异性强、快速准确检 测肉毒梭菌的TaqMan 探针荧光定量PCR 方法。
1 材料与方法 1.1 材料 1.1.1 菌株伤寒沙门菌(H901 50097) 由北京军事医学科 学院惠赠; 变形杆菌(49027) 由北京药检所惠赠; 金黄色葡萄 球菌(ATCC6538) 、肠出血型大肠埃希菌O157: H7 2 株(883、 88236) 和DH5ɑ 由本系保存; 肉毒梭菌阳性模板人工合成。
1.1.2 试剂pUC57(Amp + ) 载体克隆系统(美国Promage 公司) ; 质粒小提试剂盒(北京天根生化科技有限公司) ; Premix Ex TaqTM (Perfect Real Time) 、DNA marker、Taq Master 酶(大连TaKaRa 公司) ; Tirs-乙二胺四乙酸(ethylenediaminetetraacetic, EDTA,简称TE) 溶液、Luria-Bertani 培养基 (LB) 等自行配制。
1.1.3 仪器蛋白核酸检测仪(美国GE 公司) ; PCR 仪(德 国Tgradient 公司) ; 凝胶成像分析系统(英国UVItec 公司) ; Mx3005P 实时荧光定量PCR 仪(美国Stratagene 公司) ; 生物 安全柜(新加坡ESCO 公司) 等。
1.2 方法 1.2.1 atx 基因引物与探针的设计根据Sebaihia 等〔4〕公布 的A 型肉毒梭菌神经毒素基因atx 序列(GenBank No: CBO0806) ,利用DNAMAN 软件进行同源性分析,Primer Express 3.0 软件设计PCR 引物和TaqMan 探针,引物atx1 序列 为5'-ATGGTTATGGCTCTACTCAATACATTAG-3',引物 atx2 序列为5'-CACCTAAAAGAGGATTTGTATCAACTTC- 3',TaqMan 探针序列为5'-TGACTCCTCAAAACCAAATGTAAAATCTGGGCT- 3',探针5' 端标记羧基荧光素(carboxy fluorescein,FAM) ,3 ' 端标记淬灭基团(Black hole quencher, BHQ) 。引物和探针由上海生工生物工程有限公司合成。
1.2.2 atx 标准质粒的构建A 型肉毒梭菌为严格管控菌 种,本文根据GenBank 上的atx 基因序列,人工合成目的片 段,作为后续实验的模板。对模板进行PCR 扩增,连接到 pUC57(Amp + ) 载体,制备重组质粒,转化DH5ɑ 感受态细胞 增殖培养,抽提回收,测定重组质粒浓度和纯度,PCR 鉴定。
1.2.3 标准曲线制作利用构建的pUC57 重组质粒作为肉 毒梭菌定量标准品,根据测定的质粒浓度对标准品进行10 倍 梯度稀释。优化的反应体系为Taq 酶10.0 μL、上下游引物 和探针各0.5 μL、ROX reference dyeⅡ 0.5 μL、DNA 模板 1.0 μL、去离子水7.0 μL,共20.0 μL。反应程序: 95 ℃预变 性30 s,以95 ℃ 5 s,60 ℃ 30 s,扩增40 个循环,反应时间约1 h。利用优化的反应条件检测各梯度标准品的Ct 值,建立质 粒拷贝数与其对应关系的定量标准曲线。
1.2.4 荧光定量PCR 的灵敏度检验将已知拷贝数的重组 质粒用TE 溶液进行10 倍梯度极限稀释,对各稀释浓度的模 板同时进行普通PCR 和荧光定量PCR 检测,比较2 种方法对 靶基因片段的最低检出限。
1.2.5 荧光定量PCR 的特异性检验采用菌落PCR 方 法〔5〕,以人工模拟的细菌混合液为食品污染样品,验证该法 检测atx 基因的特异性。实验以含重组质粒的样品作为阳性 品,以5 株食源性细菌作为阴性对照菌株,以上述细菌的混合 液作为污染的模拟样品,以去离子水作为无模板空白对照 (no template control,NTC) 。反应程序: 95 ℃预变性5 min, 以95 ℃ 1 min,60 ℃ 30 s,扩增35 个循环,反应时间约 90 min。
1.2.6 荧光定量PCR 的重复性以拷贝数为2.2 × 105 的重 组质粒作为检测模板,利用同一实验条件检测分装的15 份平 行样品的Ct 值变异系数(标准差/重复样品的算术均数) 来 初步评估该方法的重复性。
2 结 果 2.1 标准品的制备与鉴定(图 1)
|
注: M: DL500 DNA marker; 1: 扩增的目的片段(96bp) ; 2: 无模 板空白对照。 图 1 肉毒神经毒素atx 基因扩增片段鉴定 |
实验测得抽提的重组质 粒浓度为66.54 ng /μL,OD260 /280 为1.868,说明该重组质 粒的纯度较高。根据阿伏伽德罗常数计算重组质粒的拷贝数 为2.2 × 1010 copies /μL。取稀释的重组质粒作为模板,进行 PCR 扩增,3 % 琼脂糖凝胶电泳鉴定。在100 bp 处可见一明 亮条带,扩增产物大小为96 bp。
2.2 荧光定量PCR 标准曲线利用优化好的反应体系对5 个10 倍梯度稀释的定量标准品进行检测,标准曲线在2.2 × 103 ~ 2.2 × 107 拷贝数之间有较好的线性关系,相关系数为 0.997,扩增效率为101.1%,得到标准品拷贝数与Ct 值的线 性方程为: Ct = - 3.296 × LOG(copies) + 42.69。对样品进行 检测时,根据其Ct 值和线性方程就可获得该样品DNA 拷 贝数。
2.3 荧光定量PCR 灵敏度检测(图 2)
|
注: M: DL500DNA marker; NTC: 无模板空白对照; 106 ~ 100 : 各 样品质粒浓度拷贝数。 图 2 肉毒梭菌PCR 极限浓度检测 |
将已知拷贝数的重 组质粒进行10 倍梯度极限稀释,对2.2 × 106 ~ 2.2 × 100 拷贝 数样品进行荧光定量PCR 和普通PCR 检测。实验结果可 知,荧光定量PCR 最低可检测到2.2 × 101 个拷贝数; 而普通 PCR 检测中,当质粒浓度为103 拷贝数时,可见一微弱条带, 表明普通PCR 的最低检出限约为2.2 × 103 个拷贝数。
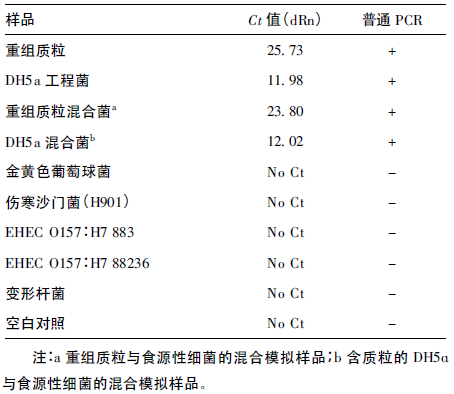
2.4 荧光定量PCR 特异性检测(表 1)| 表 1 肉毒梭菌特异性检测结果 |
利用本实验建立的 肉毒梭菌荧光定量PCR 检测方法对肉毒梭菌标准品和5 株 食源性细菌进行检测,只有含atx 基因扩增片段的4 个样品 出现典型的扩增曲线,为阳性结果; 而其他食源性细菌和空白 对照均为一平直线,Ct 值无法读取,判为阴性。结果与普通 PCR 检测完全一致。
2.5 荧光定量PCR 重复性检测为评估该检测方法的重复 性,本研究对同一浓度模板的15 个样品进行检测,并统计获得 的Ct 值。结果显示,15 个样品的Ct 值读数范围为25.51 ~ 26.65,标准差为0.27,变异系数为1.0%。表明本实验建立的 肉毒梭菌荧光定量PCR 检测方法重复性较好,可对A 型肉毒 梭菌样品进行稳定、可靠的检测。
3 讨 论肉毒梭菌具有极强的神经毒性,被列为重要的生物战剂, 一般很难得到该菌样品。随着基因工程技术的发展,免疫 PCR〔3〕、分子信标PCR〔6〕、荧光定量PCR〔7〕等分子克隆技术 在病原微生物领域广泛应用,使得人工合成基因序列检测重 要管控病原微生物成为可能。本文通过合成肉毒梭菌毒素基 因序列,作为检测的模拟阳性样品,建立荧光定量PCR 快速 检测方法,用于高度危险、不易获得的病原微生物检测。
研究结果显示,荧光定量PCR 检测灵敏度达到22 个 DNA 拷贝数,与Fach 等〔8〕的实验结果基本一致,比普通PCR 提高了100 倍,可用于微量污染样品的检测。实验检测含肉 毒毒素基因样品均呈阳性,其他菌株均为阴性,表明本方法对 肉毒梭菌有较高的检测特异性,而且可重复性好,能保证对样 品进行稳定、可靠的检测。同时该技术自动化程度高,封闭环 境,无后处理,保障了实验人员的安全,适合于临床大规模快 速检测。结合菌落PCR 技术简化了细菌基因组提取的繁琐 步骤,比传统检测方法大大缩短了检出时间。
与传统的肉毒梭菌检测方法相比,本研究建立的荧光定 量PCR 检测方法具有灵敏度高、特异性强、操作简单、省时省 力等特点,为肉毒梭菌检测和流行病学调查提供了有力工具, 适用于肉毒中毒高发区进出口物品检验检疫、食品安全检测、 致病菌临床诊断及生物安全防护等领域,应用前景广阔。
| 〔1〕 | 杨慧盈,王慧,荫俊,等.A型肉毒神经毒素基因的PCR检测 [J].生物技术通讯,2006,17(1):37-39. |
| 〔2〕 | 张雪平.肉毒毒素生物学活性及肉毒中毒病原检测方法的研究进展[J].中国生物制品学杂志,2009,22(7):728-733. |
| 〔3〕 | Chao HY,Wang YC,Tang SS,et al.A highly sensitive immunepolymerase chain reaction assay for Clostridium botulinum neurotoxin type A[J].Toxicon,2004,43(1):27-34. |
| 〔4〕 | Sebaihia M,Peck MW,Minton NP,et al.Genome sequence of a proteolytic(group I)Clostridium botulinum strain Hall A and comparative analysis of the clostridial genomes[J].Genome Res, 2007,17(7):1082-1092. |
| 〔5〕 | 徐丽,蔡俊鹏.菌落PCR方法的建立及其与常规PCR方法的比较[J].华南理工大学学报:自然科学版,2004,32(5):51-55. |
| 〔6〕 | 万成松,谭翰清,温文川.副溶血性弧菌tdh基因的分子信标PCR技术检测[J].中国公共卫生,2006,22(12):1475-1477. |
| 〔7〕 | 覃倚莹,吴晖,肖性龙,等.toxR基因作为荧光定量PCR靶基因设计TaqMan探针快速检测副溶血弧菌[J].生物工程学报, 2008(10):1837-1842. |
| 〔8〕 | Fach P,Micheau P,Mazuet C,et al.Development of real-time PCR tests for detecting botulinum neurotoxins A,B,E,F producing Clostridium botulinum,Clostridium baratii and Clostridium butyricum[J].J Appl Microbiol,2009,107(2):465-473. |
 2012, Vol. 28
2012, Vol. 28