食物过敏反应已经成为临床上常见病〔1〕。在过敏人群中,对鱼类具有特异性反应的占相当比例〔2〕。鱼类过敏作用域可以发生腹痛,腹泻,哮喘等症状〔3〕。parvalbumin是鱼肉组织中主要的致敏组分,其分子量很低,约为12kD,国内研究者已经进行了分离纯化,过敏原性初步鉴定〔4〕以及基因克隆表达等分子生物学相关研究〔5〕。parvalbumin单克隆抗体制备及相关应用研究报道较少。本研究利用重组parvalbumin作为抗原制备抗parvalbumin单克隆抗体,为parvalbumin致敏机理研究及过敏原定量检测提供依据。
1 材料与方法 1.1 主要试剂与仪器福氏完全佐剂和不完全佐剂、 Ig类与亚类二抗、羊抗小鼠IgG-HRP、聚乙二醇(美国Sigma公司);链酶亲和素-HRP(美国KPL公司);NHS-biotin(美国Pierce公司);胎牛血清培养液(DMEM)、次黄嘌呤-氨喋呤-胸腺嘧啶(hypoxanthine aminopterin and thymidine,HAT)、青链霉素、胎牛血清(美国Gibco公司);hybridoma selection mediummedium D(selection and cloning)(美国ClonaCell®-HY公司);HiTrap protein A、硝酸纤维素膜(美国Amersham公司);蛋白marker(美国Fermentas公司);蛋白质电泳转移仪(美国Bio-Rad公司),酶标分析仪(深圳雷杜生命科学股份有限公司)。小鼠骨髓瘤细胞NS-1(汕头大学医学院炎症学与变态反应学实验室);parvalbumin由本实验室制备纯化。
1.2 方法 1.2.1 动物免疫BALB/c小鼠(广东省医学实验动物中心,许可证号码: SCXK(粤)2003-0002),5只,雌性,4~6周龄。重组parvalbumin免疫,每次50μg/只。第1次采用福氏完全佐剂,与蛋白液等体积混匀,后3次免疫采用福氏不完全佐剂,每3周免疫1次。测定小鼠血清效价,选取免疫效果最佳者于融合前3 d用,重组parvalbumin蛋白尾静脉注射加强免疫(100 μg)。
1.2.2 血清抗体效价测定免疫4次后,经尾静脉采血测定血清中抗体效价。取重组蛋白,包板,1 μg/mL,100 μL/孔,4 ℃包被16 h;封闭液(1 %牛血清白蛋白、 0.1 % Tween20)300μL/孔,4 ℃封闭16 h,磷酸盐缓冲液-吐温-20(PBS2T)洗板3次;血清稀释后加样,37 ℃孵育1 h,PBS2T洗板3次;加1∶ 1 000稀释的羊抗鼠HRP-IgG,37 ℃孵育30 min,PBS2T洗板5次;加ELISA底物A、 B液,避光37 ℃显色10 min,2 mol/L硫酸50 μL/孔终止反应;450 nm波长下测定A值,P/N > 2.1为阳性。
1.2.3 杂交瘤细胞制备、筛选和克隆化分别收集免疫小鼠脾细胞和NS-1细胞以约1∶ 5的比例在50%聚乙二醇作用下按常规方法融合。融合后的细胞沉淀用2.5 mL完全培养液轻悬加入22.5 mL半固体培养基medium D混匀后倒入直径3.5 cm的平皿中,每个平皿约2 mL,37 ℃,5% CO2培养。1周后肉眼可见平皿的培养基表面有白色斑点,显微镜下即为细胞克隆团。无菌条件下将平皿中分散的、单个细胞团吸起放入96孔板培养液中,继续培养。96孔板中细胞长至视野1/3时,间接ELISA法进行检测,阳性孔用有限稀释法进行亚克隆。
1.2.4 腹水制备及纯化将6周龄以上BALB/c小鼠腹腔注射0.5 mL/只石蜡,诱导1周后腹腔注射1×106个杂交瘤细胞,7~10 d后可产生腹水。收集腹水离心除去细胞碎片。参照HiTrap protein A亲和层析说明书进行腹水的抗体纯化。
1.2.5 抗体纯度鉴定十二烷基磺酸纳一聚丙烯酰胺凝胶电泳(SDS-PAGE)检测纯化后抗体纯度。
1.2.6 抗体效价检测将重组parvalbumin作为抗原包被ELISA板条,腹水稀释体积从1 ∶ 100开始做梯度稀释至1∶ 800 000;辣根过氧化物酶(HRP)标记的羊抗鼠IgG为二抗。3,3,,5,5,-四甲基联苯胺(TMB)显色,终止后于450nm波长下读取吸光值,P/N > 2.1为阳性。
1.2.7 抗体亚型测定间接ELISA方法,IgG1,IgG2a,IgE为二抗测定抗体亚型。
1.2.8 抗体特异性鉴定蛋白免疫印迹法(western blot)检测抗体特异性。通过间接ELISA方法检测抗体与其余7类主要食物过敏原(花生,牛奶,大豆,小麦,虾,榛子,鸡蛋)的交叉反应情况。
2 结果 2.1 抗小清蛋白杂交瘤细胞株的建立重组小清蛋白免疫小鼠后定期检测血清效价,选取血清滴度最高的小鼠,取脾脏进行细胞融合。筛选期间使用重组parvalbumin,鱼蛋白粗提液及PET-28空载体表达产物分别包被ELISA板进行筛选,剔除假阳性细胞株。根据细胞生长状况每7~10 d亚克隆化1次融合细胞,直到获得阳性率为100%的细胞株。使用此方法共获得7株抗小清蛋白单克隆细胞株: 1G1,1B5,1A5,2B9,1H4,1B7,1G3。
2.2 抗体纯化(图 1)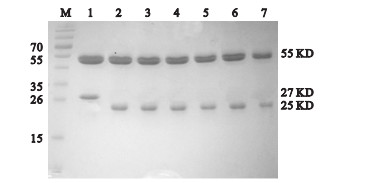 | 注: M:蛋白标准;1~7: 1H4、 1G3、 1A5、 1G1、 1B5、 2B9、 1B7 图 1 抗体纯度鉴定 |
纯化后抗体经过SDS-PAGE分析,可见清晰的2条蛋白条带,位于55 kD附近处的为抗体重链,位于25~26 kD附近的为轻链,纯化后的抗体纯度较高,未见有其他杂蛋白条带。
2.3 抗体效价测定及免疫球蛋白亚型鉴定间接ELISA法测定7株单抗的效价结果显示1G1、 1B7、 1A5、 1H4和1G3 5株抗体在稀释比例为1: 400 000,P/N > 2.1,且1G1、 1B7、1A5、 1H4吸光值仍维持在高于2.0,线性良好;1B5效价为1∶ 200 000;2B9效价最低,最大稀释比例仅为1: 10 000。间接ELISA法检测Ig亚型表明所有抗体均为IgG1型。
2.4 抗体特异性鉴定 2.4.1 抗体特异性(图 2)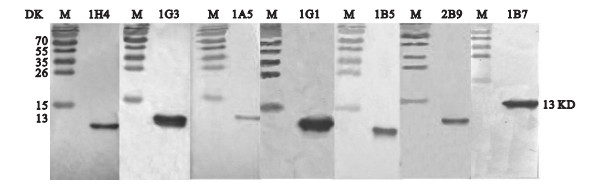 | 注: M为蛋白标志物。 图 2 抗Parvalbumin单克隆抗体免疫印迹鉴定 |
重组表达的parvalbumin分子量约为13 kD,通过western blot检测后,13 kD处可见清晰阳性条带,表明7株抗体均可与parvalbumin结合。其中1G1、 1B7和1G3与目的蛋白呈现强阳性反应,与效价检测结果基本相符。1B7阳性条带与其他单抗阳性反应条带比较为偏上的原因是由于跑胶所致。
2.4.2 抗体与其他7类过敏原蛋白交叉反应性(图 3)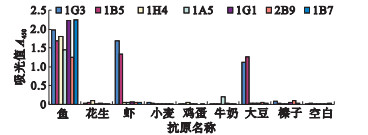 | 图 3 抗Parvalbumin单克隆抗体的交叉反应 |
1G1,1A5,2B9,1H4,1B7与其他7类常见食物过敏原均无交叉反应,特异性反应较高。7株抗体中IG3和1B5与虾和大豆出现严重交叉反应,不适合用于过敏原检测。
3 讨论近年来调查显示食物过敏症的发病在很多地区呈现上升趋势〔6〕。发达国家很早就已经强制进行食物过敏原标签政策〔7〕。对过敏原标识及开发相应检测体系的工作在中国发展较慢,过敏原检测所需试剂盒,大多依赖进口,价格昂贵。因此,开发自主过敏原检测试剂具有重要的经济和社会效益。本研究结果显示的效价较高的单克隆抗体1G1、 1B7、 1A5有可能在实现配对后进行产业化开发。对于食物过敏目前尚无确定的治疗方法,只能通过食物规避进行预防。然而不同种类过敏原在蛋白结构上的相似性所带来的交叉反应给食物规避带来很大困难〔8〕。使用单克隆抗体与重组或天然过敏原进行结合实验,可以鉴定过敏原交叉结构,为临床症状的诊断提供基础〔9〕。本研究的过敏原交叉实验结果显示1B5和1G3 2株抗体与虾和大豆致敏原有交叉现象,提示parvalbumin和虾、大豆2类过敏原可能存在交叉表位。因此,1B5和1G3虽然不能用于过敏原检测,但可以在parvalbumin与虾和大豆蛋白过敏原交叉表位的研究中发挥重要作用。
| 〔1〕 | Sampson HA.Update on food allergy[J].Allergy Clin Immunology,2004,113(5):805-819. |
| 〔2〕 | Wild LG,Lehrer SB.Fish and shellfish allergy[J].Curr Allergy Asthma Rep,2005(1):74-79. |
| 〔3〕 | 伊芳,汪宁,吴涛.水产品中过敏原的研究进展[J].畜牧与饲料科学,2010,31(10):91-92. |
| 〔4〕 | 刘光明,梁银龙鲤鱼小清蛋白的纯化及其过敏原性鉴定[J].食品科学,2009,30(3):188-191. |
| 〔5〕 | 李荔,吴曾闵,刘志刚.紫红笛鲷过敏原小清蛋白基因克隆及序列分析[J].中国公共卫生,2008,24(9):1078-1080. |
| 〔6〕 | 詹政科,刘萍.双抗体夹心 ELISA 法测定食物中牛奶过敏原蛋白成分[J].中国乳品工业,2009,37(5):44-47. |
| 〔7〕 | Burks AM.Peanut allergy[J].Lancet 2008,37 (13):1538-1546. |
| 〔8〕 | Barre A,Borges JP,Culerrice R,et al.Homology modelling of the mmajor peanut allergen Ara h 2 and surface mapping of IgE-binding epitopes[J].Immunology Letters,2005,100:153-158. |
| 〔9〕 | Justus A.Cat IgA,representative of new carbohydrate cross-reactive allergens[J].Allergy Clin Immunology,2007,119(3):640-645. |
 2012, Vol. 28
2012, Vol. 28


