脂联素(adiponectin)是近年来发现的脂肪细胞特异性分泌因子〔1〕,具有调节糖脂代谢、胰岛素增敏及抗炎抗动脉粥样硬化等一系列作用。肥胖症、II型糖尿病及心血管疾病患者血浆脂联素浓度明显低于正常人,并与胰岛素抵抗和高胰岛素血症成负相关〔2, 3〕。现已知过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)是体内脂肪酸的感受器,在调控脂肪细胞分化、调节糖脂代谢中起关键作用〔4, 5〕。临床上采用的噻唑烷二酮类抗糖尿病药物,如吡格列酮(pioglitazone)等可通过激活PPARγ来上调脂联素的表达〔6, 7〕。脂肪酸作为PPARγ的天然配体是否通过PPARγ来调节脂联素的表达是值得研究的问题。本实验主要观察不同种类的脂肪酸对脂联素基因表达的调节作用及与PPARγ基因表达的相互关系,为肥胖及相关疾病的预防和治疗提供参考依据。
1 材料与方法 1.1 实验材料3T3-L1前脂肪细胞(美国ATCC公司);高糖Dulbecco's modified eagle media (DMEN)培养基(美国Gibco公司);胎牛血清(fatal bovine serum,FBS)(杭州四季清公司);1-甲基-3-异丁基-黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松、胰岛素、棕榈酸(palmitic acid,PA)、油酸(oleic acid,OA)、亚油酸(linoleic acid,LA)、fatty acidfree牛血清白蛋白(albumin from bovine serum,BSA)、吡格列酮(pioglitazone)、GW9662(美国Sigma公司);Trizol (美国Invitrogen公司);SYBR ® PrimeScript ® RT-PCR Kit II (Perfect Real Time)、SYBR ® Premix Ex TaqTM II (perfect real time)(大连TaKaRa公司)。
1.2 3T3-L1前脂肪细胞的培养及诱导分化按常规细胞培养方法,用含10% FBS的高糖DMEN培养基在37℃、5% CO2条件下培养细胞,隔天换液。取对数生长期的3T3-L1前脂肪细胞均匀接种于6孔板中,待细胞生长至接触抑制后2 d,换含10% FBS、0.5 mmol/L IBMX、10 μg/ml胰岛素、1 μmol/L地塞米松的高糖DMEN诱导培养基;2 d后换只含10 μg/mL胰岛素的完全培养基继续培养;2 d后换完全培养基,隔天换液,培养8~10 d。经油红O染色鉴定,90%以上3T3-L1前脂肪细胞分化为成熟脂肪细胞,可用于下步实验〔7, 8, 9〕。
1.3 脂肪酸处理PA、OA、LA储存液以每100 mg溶于1 mL无水乙醇进行溶解,置液氮保存。Fatty acid-free BSA溶于三蒸水中配制成10%储备液,55℃助溶,过滤除菌。脂肪酸使用液的配置参照Richard T等〔8, 10, 11〕方法并加以改进,将上述脂肪酸使用液加入无血清的只含1% BSA的高糖DMEN中,于37℃、5% CO2条件下培育至所需时间。PPARγ激动剂吡格列酮〔9〕和PPARγ阻断剂GW9662〔12〕以上述同样方法溶解、储存并使用,空白对照组则添加相同用量但不含脂肪酸的无水乙醇、氢氧化钠和BSA混合物。实验重复3次。在相应条件下以不加脂肪酸的3T3-L1成熟脂肪细胞为空白对照,分别加入浓度为25、50、100、200、400 μmol/L的PA、OA、LA,以100 μmol/L pioglitazone和100 μmol/L GW9662作为阳性对照和阴性对照,培养24 h,收获细胞,每组3孔。
1.4 总RNA提取Trizol法提取总RNA (按Trizol试剂说明书进行操作)。RNA纯度与含量测定:取2μL RNA 50倍稀释后于核酸蛋白分析仪测定RNA纯度与浓度,纯度在1.8~2.0,用于后续试验。
1.5 mRNA表达水平分析(qRT-PCR法) cDNA逆转录:取1 μg总RNA在10 μL体系中进行逆转录,实验操作按试剂盒说明书进行,所得产物即为所需的模版cDNA。实时荧光定量PCR检测:由北京奥科生物技术有限公司合成并验证引物,以β-actin为内参。引物序列如下,adiponectin上游引物序列(5'-GGAACTTGTGCAGGTTGGAT-3'),下游引物序列(5'-TCTCCAGGAGTGCCATCTCT-3'),产物长度为92 bp;PPARγ上游引物序列(5'-ACAGACCTCAGGCAGATCGT-3'),下游引物序列(5'-GGGTGAAGGCTCATGTCTGT-3'),产物长度为83 bp;β-actin上游引物序列(5'-GATCATTGCTCCTCCTGAGC-'3),下游引物序列(5'-ACATCTGCTGGAAGGTGGAC-3'),产物长度为83 bp。实时荧光定量PCR总反应体系为25 μL。反应条件为,95℃预变性5 min;95℃、5 s,60℃、30 s,40个循环,每个循环结束检测荧光信号。结果采用2-△△Ct相对定量的方法〔13〕,以β-actin作为内参。所用定量PCR仪器型号为STRATAGENE Mx3005p cycler。
1.6 统计分析所得数据采用x±s表示,采用SPSS 13.0软件进行统计分析,各组数据先进行正态性和方差齐性检验,组间比较及两两比较采用方差分析(One Way ANOVA)及LSD t-test或dunnett t-test,相关性分析采用Pearson相关分析。P < 0.05表示为差异有统计学意义。
2 结果 2.1 3T3-L1前脂肪细胞诱导分化及鉴定(图 1)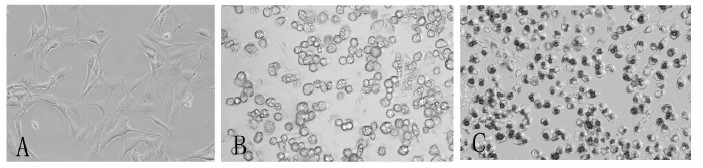 | 注: A: 3T3-L1 前脂肪细胞( × 400) ; B: 成熟脂肪细胞( × 200) ; C: 3T3-L1 成熟脂肪细胞油红O 染色( × 200) 。 图 1 3T3-L1 脂肪细胞 |
未分化的3T3-L1前脂肪细胞显微镜下观察呈类成纤维状,细胞成菱形或梭型,此时油红O不能着色(图 1-A)。前脂肪细胞在分化培养基中诱导分化第2 d,细胞回缩,形态变圆、体积逐渐增大;分化第4 d开始,胞内可见小脂滴,并随着分化的进展,胞质内脂滴迅速增多,并逐渐融合;分化第8~10 d,90%以上分化为成熟脂肪细胞,脂滴大量融合(图 1-B)。油红O染色,用于鉴定脂肪细胞(图 1-C)。
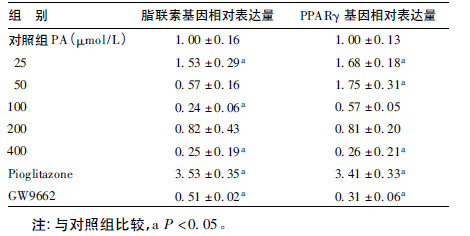
2.2 棕榈酸(PA)对脂联素及PPARγ mRNA表达的影响(表 1)| 表 1 PA 对脂联素及PPARγ mRNA 表达的影响 |
以不同浓度的PA分别处理3T3-L1成熟脂肪细胞24 h,在浓度为25 μmol/L时脂联素mRNA表达明显增加,比对照组增加53%(P < 0.05);其余浓度脂联素mRNA表达均下降,在400 μmol/L时明显降低,比对照组降低76%(P < 0.05)。在浓度为25、50 μmol/L时,PPARγ mRNA表达明显增加,与对照组相比分别增加67%和75%(P < 0.05);其余浓度时表达均下降,在400 μmol/L时,比对照组降低74%(P < 0.05)。经Pearson相关分析,脂联素mRNA表达与PPARγmRNA表达存在明显正相关关系。相关系数r=0.562,P=0.015。
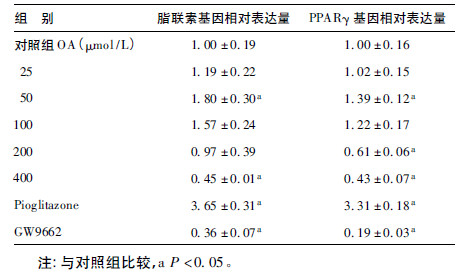
2.3 油酸(OA)对脂联素及PPARγ mRNA表达的影响(表 2)| 表 2 OA 对脂联素及PPARγ mRNA 表达的影响 |
以不同浓度的OA分别处理3T3-L1成熟脂肪细胞24 h,在浓度为25、50、100 μmol/L时,脂联素mRNA的表达均高于对照组,在50 μmol/L时最为明显,比对照组增加80%(P < 0.05);随着浓度的增加,脂联素mRNA表达下降,在400 μmol/L时明显低于对照组,减少55%(P <0.05)。在浓度为25、50、100 μmol/L时,PPARγmRNA的表达增加,在50μmol/L明显增加,比对照组增加39%(P < 0.05);随着浓度的继续增加,PPARγ mRNA表达均下降,在200、400 μmol/L时,分别比对照组减少39%和57%(P < 0.05)。经Pearson相关分析,脂联素mRNA表达与PPARγ mRNA表达存在明显正相关关系。相关系数r=0.893,P=0.000。
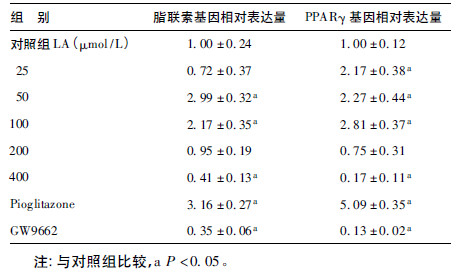
2.4 亚油酸(LA)对脂联素及PPARγ mRNA表达的影响(表 3)| 表 3 LA 对脂联素及PPARγmRNA 表达的影响 |
以不同浓度的LA分别处理3T3-L1成熟脂肪细胞24 h,在浓度为50、100 μmol/L时脂联素mRNA的表达明显增加,分别比对照组增加190%和110%(P < 0.05);当浓度为400 μmol/L时,表达明显下降,比对照组减少59%(P < 0.05)。在浓度为25、50、100 μmol/L时,PPARγmRNA的表达增加并呈梯度上升,分别比对照组增加117%、127%、180%(P < 0.05);当浓度为200、400 μmol/L时,PPARγ mRNA表达下降,其中400 μmol/L时明显低于对照组,减少83%(P < 0.05)。经Pearson相关分析,脂联素mRNA表达与PPARγ mRNA表达存在明显正相关关系。相关系数r=0.681,P=0.002。
3 讨论本研究以3T3-L1前脂肪细胞进行体外培养,经常规方法诱导分化成熟后用于实验。3T3-L1前脂肪细胞是目前国际上研究脂肪细胞因子功能最常用的细胞株;诱导分化成熟的3T3-L1脂肪细胞可高水平表达脂联素和PPARγ基因。
本研究观察了饱和脂肪酸棕榈酸(PA)、单不饱和脂肪酸油酸(OA)、多不饱和脂肪酸亚油酸(LA)在不同浓度情况下作用24 h对3T3-L1脂肪细胞脂联素和PPARγ基因表达的影响。发现棕榈酸只在浓度很低(25 μmol/L)时能上调脂联素及PPARγ基因的表达,在其余浓度均表现为抑制作用;油酸和亚油酸在25~100 μmol/L浓度范围内均上调脂联素及PPARγ基因的表达,与袁继红等〔14〕在50和100 μmol/L剂量作用48 h油酸和亚油酸均下调脂联素表达的研究结果不同,提示脂联素的表达可能与脂肪酸作用时间有关。本实验还观察到当浓度继续增加时,油酸和亚油酸均下调脂联素及PPARγ基因的表达,且浓度越高下调作用越明显。现有研究证明氧自由基可下调脂联素表达〔15〕,而多不饱和脂肪酸易产生脂质过氧化,因此本实验所观察到高浓度时油酸和亚油酸下调脂联素表达是否与脂质过氧化有关值得进一步探讨。另外,经相关性分析结果表明,脂联素与PPARγ基因表达之间存在明显正相关关系,提示不同脂肪酸影响脂联素的表达有可能通过激活或抑制PPARγ的表达来实现。
另外,以往多数研究均观察到饱和脂肪酸下调脂联素表达〔16〕,而本研究发现饱和脂肪酸棕榈酸在很低浓度(25 μmol/L)时也能上调脂联素及PPARγ基因的表达,其机别有待探讨。本研究提示脂肪酸的种类、浓度和作用时间等都是影响脂联素表达的重要因素,有可能通过调整膳食脂肪酸种类、构成、数量等来增加脂联素的基因表达和分泌,发挥其有益作用。
| 〔1〕 | Maeda K, Okubo K, Shimomura I, et al.cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (adipose most abundant gene transcript 1)[J]. Biochem Biophys Res Commun, 1996, 221(2):286-289. |
| 〔2〕 | Arita Y, Kihara S, Ouchi N, et al.Paradoxical decrease of an adipocyte-specific protein, adiponectin in obesity[J]. Biochem Biophys Res Commun, 1999, 257(1):79-83. |
| 〔3〕 | 夏道曼, 陈秋.脂肪细胞因子与胰岛素抵抗关系研究进展[J]. 中国公共卫生, 2009, 25(12):1507-1509. |
| 〔4〕 | 李晓寒, 宋明, 阴瑞兰.白藜芦醇对高脂饮食大鼠心肌 PPARγ/AP1信号影响[J]. 中国公共卫生, 2011, 27(5):589-590. |
| 〔5〕 | 陈思凡, 肖新才, 郑琳, 等.尼克酰胺对小鼠前脂肪细胞增殖及分化影响[J]. 中国公共卫生, 2011, 27(8):1014-1015. |
| 〔6〕 | Phillips SA, Kung JT.Mechanisms of adiponectin regulation and use as a pharmacological target[J]. Current Opinion in Pharmacology, 2010, 10(6):676-683. |
| 〔7〕 | Kudoh A, Satoh H, Hirai H, et al.Pioglitazone upregulates adiponectin receptor 2 in 3T3-L1 adipocytes[J]. Life Sciences, 2011, 88(23-24):1055-1062. |
| 〔8〕 | Oster RT, Tishinsky JM, Yuan Z, et al.Docosahexaenoic acid increases cellular adiponectin mRNA and secreted adiponectin protein, as well as PPARγ mRNA, in 3T3-L1 adipocytes[J]. Appl Physiol Nutr Metab, 2010, 35(6):783-789. |
| 〔9〕 | Choi SS, Cha BY, Iida K, et al.Artepillin C, as a PPAR[gamma] ligand, enhances adipocyte differentiation and glucose uptake in 3T3-L1 cells[J]. Biochemical Pharmacology, 2011, 81 (7):925-933. |
| 〔10〕 | Komiya K, Uchida T, Ueno T, et al.Free fatty acids stimulate autophagy in pancreatic b-cells via JNK pathway[J]. Biochemical and Biophysical Research Communications, 2010, 401(4):561-567. |
| 〔11〕 | Yang LN, Qian Z, Ji H, et al.Inhibitory effect on protein kinase C theta by crocetin attenuates palmitate-induced insulin insensitivity in 3T3-L1 adipocytes[J]. European Journal of Pharmacology, 2010, 642(1-3):47-55. |
| 〔12〕 | 于杨, 杜优优, 陈曼华.过氧化物酶体增殖物活化受体在替米沙坦上调 3T3-L1脂肪细胞脂联素表达中的作用[J]. 实用医学杂志, 2010, 26(9):1499-1501. |
| 〔13〕 | Livak KJ, Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4):402-408. |
| 〔14〕 | 袁继红, 龙欢, 雷霆, 陈小冬, 等.成熟脂肪细胞中脂联素基因表达的脂肪酸应答调控[J]. 华中农业大学学报, 2009, 28(3):320-325. |
| 〔15〕 | 陈宝莹, 魏经国, 王玮, 等.氧自由基对脂肪细胞中脂联素表达的下调作用[J]. 心脏杂志, 2008, 20(2):142-146. |
| 〔16〕 | Naderali EK, Estadelia D, Rocha M, et al.A fat-enriched glucoseenriched diet markedly attenuates adiponectin mRNA levels in rat epididymal adipose tissue[J]. Clin Sci (Lond), 2003, 105 (4):403-408. |
| 〔17〕 | Puglisi MJ, Hasty AH, Saraswathi V.The role of adipose tissue in mediating the beneficial effects of dietary fish oil[J]. Journal of Nutritional Biochemistry, 2011, 22(2):101-108. |
 2012, Vol. 28
2012, Vol. 28