双酚A,化学名2,2-(4-羟基苯基)丙烷,广泛存在于工业废水、生活污水以及污泥中,直接威胁着饮用水源安全。双酚A已被证实为环境内分泌干扰物质,具有雌激素活性,干扰内分泌,影响人的生理功能,导致生殖功能下降,甚至免疫力降低〔1, 2〕,目前,双酚A作为环境内泌干扰物,其对哺乳动物生殖功能危害作用已经明确,但在其诱变性、致癌性研究方面尚无定论。抑癌基因P53是与人类肿瘤发生高度相关基因,目前认为,P53抑癌基因突变、易位或缺失导致失活是多种肿瘤发生发展的重要机理之一〔3〕。水生生物斑马鱼由于其对致癌物敏感,是一种致癌物检测和筛选的理想模式动物〔4〕。本研究以斑马鱼肝细胞P53基因编码区序列(CDS)为目标片段,通过逆转录-聚合酶链反应(reversetranscription-polymerase chain reaction,RT-PCR)及测序分析方法,研究低剂量双酚A暴露对鱼类DNA功能基因损伤作用,从分子毒理学角度分析和探讨双酚A诱变性,为阐明双酚A毒作用机制提供依据。
1 材料与方法 1.1 斑马鱼及饲养条件AB型斑马鱼(浙江省医学科学院卫生学研究所),体长(3.48±0.20)cm,体重(0.35±0.06)g,雌雄各半。饲养条件:光照周期为14/10h(昼/夜),水温(26±1)℃,饲养密度< 1 g/L,每日早晚定时投喂饲料各1次,并清除排泄物;在实验室条件下驯养14d,死亡率< 1%。养殖系统用水的处理参照文献〔5〕。
1.2 仪器与试剂Leica L2型体视显微镜及图像分析系统(德国Leica公司);生化培养箱(日本SANYO公司);S56U-2型水生生物养殖系统(美国Aquatic Habitats公司);PTC-200型PCR仪(美国Bio-Rad公司)。双酚A(纯度99.9%,美国Sigma公司);RNA提取试剂盒(Reansy Mini Kit)(德国QIAGEN公司);mRNA提取试剂盒(mRNA Isolation SystemⅢ)(美国Promega公司);逆转录试剂盒(M-MLV RTasecDNA Synthesis Kit);DNA聚合酶(primeSTAR HS DNAPolymerase)和胶回收试剂盒(日本TaKaRa公司)。
1.3 双酚A急性暴露试验设2.0、4.0、6.0、8.0、10.0 mg/L5个浓度,同时设空白对照,每个浓度设2个平行样。每组投放斑马鱼10尾,雌、雄各半。随机将斑马鱼置于不同浓度试液中,连续暴露96 h。前8 h连续观察,24、48、72h及96 h分别观察记录斑马鱼状态和死亡数。每天定时换掉30%预温试液,及时捞除死鱼。计算死亡率,用概率单位对数图解法求取96h LC50及95%CI。根据鱼类急性毒性分级标准,评价其毒性分级。
1.4 双酚A对P53基因诱变试验 1.4.1 双酚A暴露设空白对照组和双酚A暴露组,每组投放雄性斑马鱼10尾。根据急性暴露试验结果,设0.3 mg/L为暴露组测试浓度,连续暴露30 d,每天定时喂食,更换30%预温试液。30 d后,各组斑马鱼冰水麻醉,剪去头部,在体视显微镜下迅速分离肝组织,置于-80℃保存,备用。
1.4.2 引物设计与合成根据已公布的P53 mRNA基因序列(GenBank: AF365873.1,CDS: 142-1251),设计并合成逆转录引物及PCR引物。逆转录引物5'-CCTCCTTGTTTTGGTCATTCTTT-3';第一轮PCR引物F1: 5'-ATCGACTACATATCCGGGCAATCC-3';R2: 5'-ATGTATCGCAGTTCCCCAAATG-3';第二轮PCR引物F2: 5'-TAGTGGAGAGGAGGTCGGCAAAATCAAT-3';MR1: 5'-CAGAGTGATGATTGTGAGGATGG-3';MF2:5'-CGAACC
CCGGATGGAGATAACTTG-3';R1: 5'-AAAAAGGCAGTCCAAAAAGAGCA-3'。
参考文献〔6〕方法,采用试剂盒提取总RNA,mRNA,操作均按试剂盒说明进行。提取的mRNA溶液置于-80℃保存。于20 μL体系中,加已提取mRNA 10 μL,1 μL逆转录引物,65 ℃,保温10 min,使RNA解链,然后参照试剂盒说明书将mRNA逆转录为cDNA,保存于-20 ℃备用。
1.4.4 PCR扩增以合成cDNA为模板,通过二轮PCR,扩增出P53基因前后2段序列。第一轮PCR使用F1、R2引物扩增P53基因,扩增产物作为第二轮PCR模板。在第二轮PCR中,用F2、MR1扩增P53基因前段1~675 bp处F2MR1序列,扩增片段长715 bp;用MF2、R1引物扩增P53基因后段445~1 110 bp处MF2R1序列,片段长727 bp。两轮PCR反应体系均为:无菌水30.0 μL;10倍PCR缓冲液6.0 μL;dNTPs(2.5 mmo1/L)4.0 μL;上下游引物各1.5 μL;Taq酶(5u/μL)1.0 μL;cDNA模板6.0 μL。PCR反应条件均为: 95℃预变性5 min,94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃延伸10 min。为确定提取的mRNA溶液中是否仍有残存DNA干扰片段,另取mRNA溶液6.0 μL,进行二轮PCR扩增,产物分别作为F2MR1和MF2R1序列的未经逆转录对照。
1.4.5 PCR鉴定及测序扩增产物经1%琼脂糖凝胶电泳检测后,目的扩增片段用琼脂糖凝胶DNA回收试剂盒回收,送上海生物工程公司进行测序。
1.5 统计分析数据采用SPSS 15.0软件进行统计分析、DNAstar 7.0软件对序列进行分析。
2 结果 2.1 双酚A对斑马鱼急性毒性随着暴露时间延长及暴露浓度提高,斑马鱼死亡率呈上升趋势,72 h后趋于稳定。双酚A 96h LC50为6.18 mg/L,95% CI为4.61~8.30 mg/L。根据鱼类毒性分级标准,双酚A对鱼类急性毒性分级属高毒级。
2.2 斑马鱼P53基因扩增产物电泳分析(图 1)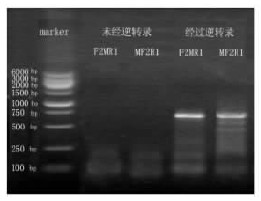 | 图 1 斑马鱼P53基因扩增产物电泳图 |
图中F2MR1、MF2R1分别为P53基因前、后半段基因序列扩增产物电泳条带。2个目的片段PCR产物电泳条带均出现在750bp附近,其大小位置与理论值基本一致。而未经逆转录处理的mRNA溶液,经同样处理后得到的PCR扩增产物在电泳图上均未出现条带,表明提取的mRNA溶液中无残存DNA干扰片段。
2.3 斑马鱼P53基因核苷酸序列分析与相似性比较对克隆斑马鱼肝细胞P53基因序列的测序分析表明,P53基因由2 211 bp组成(其中编码序列为1 122 bp),编码373个氨基酸。将斑马鱼P53序列与公布的斑马鱼P53基因序列以及黑腹果蝇、大鼠、小鼠和人类的P53基因序列进行相似性分析,结果表明,所得到的序列与网上已经登陆的斑马鱼P53序列有99.9%相似系数,而与其他物种基因序列则有较大差异,与大鼠、小鼠和果蝇的相似系数分别为31.7%、27.5%和6.5%。
2.4 双酚A诱导P53基因CDS突变位点分析(图 2)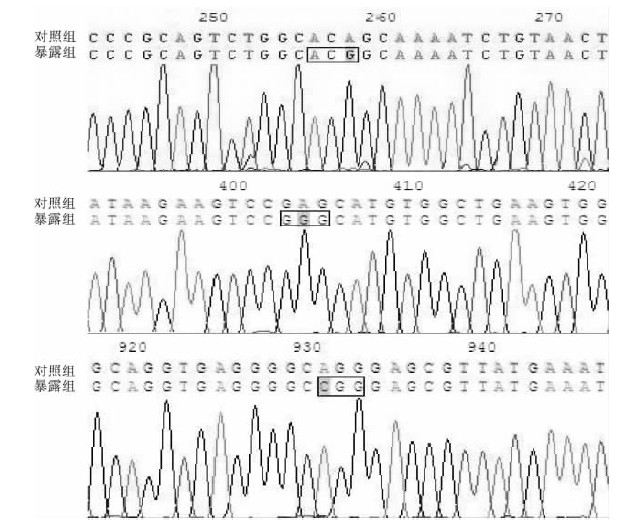 | 图 2 双酚A诱导斑马鱼P53基因CDS突变测序图谱 |
双酚A暴露组P53基因序列中有3处发生了变化,第1处在CDS258位,显示为单个碱基点突变,由A变成G,即86位密码子由ACA变成了ACG,但为同义突变,仍编码苏氨酸(Thr)。第2处在CDS 404位发生了碱基置换型突变,由A变成了G,即135位密码子由GAG变成了GGG,氨基酸由谷氨酸(Glu)变成了甘氨酸(Gly),为错义突变。第3处在CDS 931位,显示为单个碱基点突变,由A变成了C,即311位密码子由AGG变成CGG,为同义突变,仍编码精氨酸(Arg)。
3 讨论双酚A对不同种属动物毒性差异较大,其对大、小鼠属低毒类化学品,双酚A对斑马鱼96h LC50为6.18 mg/L,属高毒级。相对于双酚A毒性,斑马鱼是一种比啮齿类动物更敏感的模式动物。双酚A代谢主要是在肝脏,在尿苷二磷酸葡萄糖醛酸转移酶(UGT)催化作用下形成双酚A-单葡萄糖醛酸苷,其水溶性增加,并从胆汁、尿、粪便中排出,肝脏是双酚A重要靶器官。P53基因是化学诱变剂攻击的主要靶基因,也是与肿瘤相关性最高基因,P53基因突变,可能导致其失去对细胞生长、凋亡和DNA修复的调控作用,所以研究化学物质对其诱变性对于阐明化合物遗传毒作用及其分子机制具有重要毒理学意义。
有关双酚A致突变性和致癌性,有学者认为尚不能确定〔7〕;也有学者认为双酚A在体外试验条件下,能够引起染色体异常和DNA损伤,具有一定的遗传毒性效应,但在体内试验条件下,双酚A不会产生遗传毒性作用〔8〕。本研究结果表明,在0.3 mg/L浓度下,双酚A暴露30 d后,可诱导斑马鱼肝脏细胞P53基因发生碱基置换型突变,并导致氨基酸改变,提示在低浓度暴露及体内试验条件下,双酚A具有致突性和潜在致癌性。与已有研究〔8〕结果一致。其致突变机制有待进一步研究。
本研究结果表明,双酚A最大无作用剂量为0.3 mg/L,远高于自来水厂水样中双酚A含量〔9, 10, 11〕,但是现代毒理学认为遗传毒性致癌物和诱变剂通常无阈值(零阈值),因此,综合考虑种属差异、个体差异及暴露频率等因素,双酚A对人类基因的诱变性风险不容忽视,应采取措施降低饮用水中双酚A含量,并加强饮用水源双酚A污染监测。
志谢 衷心感谢浙江省疾病预防控制中心朱涵平、姜理平教授对本研究的指导和帮助| 〔1〕 | 郭艳英,段昌群.环境激素研究进展讨论[J].云南环境科学,2004,23(3):12-15. |
| 〔2〕 | Sonnenschein C,Soto AM.An updated review of environmental estrogen and androgen mimics and antagonists[J].J Steroid Biochem Mol Biol,1998,65(1):143-150. |
| 〔3〕 | Vogelstein B,Lane D,Levine A.Surfing the P53 network[J].Nature,2000,408(681):307-310. |
| 〔4〕 | Langheinrich U,Hennen E,Stott G,et al.Zebrafish as a model organism for the identification and characterization of drugs and genes affecting P53 signaling[J].Curr Biol,2002,12(23):2023-2028. |
| 〔5〕 | 李秀秀,杨新军,闰洪涛.农利灵对斑马鱼胚胎发育的毒性[J].环境与职业医学,2008,25(4):378-380. |
| 〔6〕 | 肖信一,苏齐鉴,刘伟,等.HIV-1病毒载量RT-PCR检测方法建立[J].中国公共卫生,2011(27) 3:273-274. |
| 〔7〕 | 邓茂先,吴德生,唐立.环境雌激素双酚A的生殖毒理研究[J].环境与健康杂志,2001,15(3):134. |
| 〔8〕 | 张江华,李华文,石丹,等.双酚A对人胚肝细胞DNA损伤和修复功能的影响[J].环境与职业医学,2005,22(3):197-199. |
| 〔9〕 | 汤先伟,金一和,张颖花,等.沈阳市自来水中的烷基酚类污染物[J].环境与健康杂志,2005,22(3):190-191. |
| 〔10〕 | 马晓雁,高乃云,李青松,等.黄浦江原水及水处理过程中内分泌干扰物状况调查[J].中国给水排水,2006,22(19). |
| 〔11〕 | 张海峰,胡建英,常红,等.SPE-LC-MS法检测杭州地区饮用水水源及自来水中的双酚A[J].环境化学,2004,23(5):584-586. |
 2012, Vol. 28
2012, Vol. 28
