脑苷脂(cerebrosides)属于糖基鞘脂类(glycosphingolipids),是单糖或低聚糖与神经酰氨末端羟基结合所形成的苷,具有抗肿瘤和免疫调节等功能〔1〕,二十碳五烯酸(eicosapentaenoic acid,EPA)也具有抗癌、改善免疫功能的作用〔2〕。二十碳五烯酸-磷脂酰胆碱(eicosapentaenoic acid-phosphatidylcholine,EPA-PC)是一种新型的海洋磷脂,前期实验已证实从罗氏海盘车中提取的脑苷脂和EPA磷脂具有很好的抗肿瘤效果。由于磷脂和糖脂的复合使用可以构成稳定的脂质体,而脑苷脂和磷脂复合使用的抗肿瘤效果相关报道较少,为此,于2009年5月-2010年10月对脑苷脂-磷脂复合脂质体同脑苷脂、磷脂脂质体单独使用的体外和体内抗肿瘤活性作用进行研究,为其进一步开发利用提供科学依据。
1 材料与方法 1.1 试剂与仪器罗氏海盘车(青岛水产品市场);RPMI-1640培养基、新生牛血清(美国Gibco公司);胆固醇(日本和光纯药工业株氏会社);四甲基偶氮噻唑蓝(3-(4,5-dimethylthiahiazol-2-y1)-2,5-diphenyl tetrazolium bromide,MTT,美国Amresco公司);LF-1型脂质体制备仪(加拿大Avestin公司);TGL-16G型台式离心机(上海安亭科学仪器厂);680型酶标仪(美国Bio-Rad公司);Bj5060UV型CO2培养箱(德国Heraeus公司);CKX41型倒置显微镜系统(日本Olympus公司)。
1.2 细胞株和实验动物S180肉瘤细胞株(山东省医学科学院基础研究所),采用含10%新生牛血清的RPMI-1640完全培养基,在37℃、5% CO2的完全饱和湿度条件下常规培养。清洁级6周龄Balb/c雄性小鼠(北京维通利华实验动物技术有限公司)50只,体重(18 ± 2) g,动物合格证号为SCXK (京)2007-0001。
1.3 实验方法 1.3.1 海星脑苷脂和海星磷脂的制备参照文献〔3〕将罗氏海盘车水煮后去壳和内脏,获得生殖腺后冻干、粉碎后经氯仿:甲醇:水(4:4:1,V/V)浸提,用乙酸乙酯:正丁醇(2:1,V/V)萃取,浓缩后经冷丙酮洗得不溶物经正、反相硅胶柱层析得海星脑苷脂及磷脂。含量经薄层层析法及高效液相色谱法鉴定,纯度> 90%。其中海星磷脂经气相色谱法对其脂肪酸组成进行分析,测得其EPA含量达47%。
1.3.2 海星脑苷脂、磷脂脂质体以及脑苷脂-磷脂复合脂质体的制备分别称取摩尔比为6:3:1的海星脑苷脂:海星磷脂:胆固醇及摩尔比为1:1的海星脑苷脂(或海星磷脂):胆固醇,分别用少量的氯仿溶于旋蒸瓶中,旋转蒸发成均匀薄膜,加入少量磷酸盐缓冲液(phosphate buffered saline,PBS)充入氮气保护,经超声波处理后,利用LF-1型脂质体制备仪,经200 nm的微孔滤膜反复过滤,得到粒径均一的脂质体〔4〕。
1.3.3 体外抗肿瘤实验将处于对数生长期的S180细胞,用RPMI-1640完全培养基(含10%新生牛血清)制成密度为2 × 104个/mL的细胞悬液,接种于96孔培养板内,加入含不同浓度的海星脑苷脂、磷脂以及海星脑苷脂-磷脂复合脂质体的完全培养基,脂质体终浓度分别为25,50,100和200 μg/mL,空白对照组加等量的不含脂质体的RPMI-1640完全培养基每个浓度设4个复孔。分别培养24、48和72 h后,1 200 r/min离心10 min,弃去培养基,加入MTT液(PBS液配制,终浓度为0.5 mg/mL)。继续培养4 h后,1 200 r/min离心,弃去培养基,加入酸化异丙醇,吹打至蓝色结晶物完全溶解,用酶标仪测570 nm处吸光值,以[(样品组吸光值)/(空白对照组吸光值)]× 100%表示在样品作用下细胞的存活率。
1.3.4 体内抗肿瘤实验依照文献〔5〕制备S180荷瘤小鼠模型,24 h后随机分为模型对照组、海星脑苷脂组、海星磷脂组和海星脑苷脂-磷脂复合组,以不接肿瘤的小鼠为正常对照组,每组10只。海星脑苷脂组、磷脂组以及复合组小鼠分别灌胃50 mg/kg剂量的海星脑苷脂、磷脂和脑苷脂-磷脂复合脂质体。正常及模型对照组灌胃生理盐水,灌胃体积为0.1 mL/10 g,1次/d,连续19 d。每隔3 d称小鼠体重,观察各组小鼠体重变化。小鼠于末次给药后12 h (禁食不禁水)称重,脱颈椎处死。仔细剥离肉瘤、脾脏、胸腺,分别称重,并计算抑瘤率、脾指数和胸腺指数。抑瘤率(%)=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重× 100%〔5〕。
1.4 统计分析采用SPSS 13.0软件进行分析,组间比较使用t检验及方差分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 海星极性脂脂质体对S180细胞增殖的影响(表 1)| 表 1 海星极性脂脂质体对S180细胞增殖活性的影响 |
海星脑苷脂-磷脂复合脂质体、海星脑苷脂脂质体和海星磷脂脂质体均明显抑制了S180细胞的增殖活性,均呈现出时间和剂量效应关系。其中海星脑苷脂-磷脂复合脂质体抑制S180细胞生长的效果好于海星脑苷脂和海星磷脂脂质体,其24、48、72 h的半数抑制浓度(IC50)分别为199.89、148.95和126.65 μg/mL。表明海星脑苷脂-磷脂脂质体可以较好的抑制肿瘤细胞的体外增殖活性。
2.2 对S180荷瘤小鼠肿瘤生长的影响海星脑苷脂、磷脂以及脑苷脂-磷脂复合脂质体对荷瘤小鼠S180肉瘤生长均有明显抑制作用。同体外实验结果一致,与模型组比较,海星脑苷脂-磷脂复合脂质体抑瘤效果最好,其抑瘤率为72.6%,而海星脑苷脂和海星磷脂的抑瘤率分别为30.8%和37.3%。
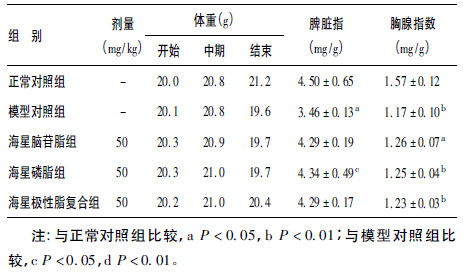
2.3 对S180荷瘤小鼠体重,脾脏和胸腺生长的影响(表 2)| 表 2 海星极性脂质体对S180荷瘤小鼠体重、脾脏指数和胸腺指数的影响 |
从各组小鼠体重变化可知,海星脑苷脂、磷脂和复合脂质体对小鼠正常生长无影响。除正常组外,其余各组体重变化趋势先增加后降低,其中海星脑苷脂-磷脂复合脂质体延缓小鼠体重的效果最佳。海星脑苷脂、磷脂和复合脂质体可提高小鼠的胸腺指数和脾指数。
3 讨论本研究结果表明,n-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)中的EPA具有良好的抗肿瘤活性,通过造成细胞线粒体损伤、促进活性氧的产生、调控凋亡相关基因的表达等方面诱导肿瘤细胞凋亡〔6〕。有文献报道富含EPA的海星磷脂主要通过提高细胞内活性氧水平和脂质过氧化产物的增加来诱导结肠癌Caco-2细胞凋亡〔7, 8〕。脑苷脂类化合物的抗肿瘤活性可能与可诱导多种癌细胞的凋亡以及作为免疫刺激因子在自身免疫等方面具有重要作用有关〔9〕。Shah等〔10〕发现,海星脑苷脂可以通过诱导Caco-2细胞凋亡从而起到抗癌作用。
本研究中体内实验海星脑苷脂-磷脂复合组小鼠体重下降发生时间晚,且下降缓慢,其原因可能与海星脑苷脂-磷脂复合脂质体抑制了肿瘤的生长及恶液质有关。此外,海星脑苷脂-磷脂复合脂质体可以增大S180荷瘤小鼠的胸腺指数和脾指数,增强其免疫功能。
体外和体内实验结果均显示出海星脑苷脂-磷脂复合脂质体具有较强的抗癌活性,其抗癌效果优于脑苷脂和磷脂脂质体单独使用,提示海星脑苷脂和磷脂复合使用时具有良好的协同作用。其抗肿瘤机制可能与诱导肿瘤细胞凋亡,抑制肿瘤细胞生长,增强机体免疫力有关。
| 〔1〕 | 陈颖,吕洁丽,段金廒,等.从生物进化看脑苷脂类化合物的分布及其生物活性研究进展[J].国际药学研究杂志,2009,36(2):121-126. |
| 〔2〕 | 许友卿,张海柱,丁兆坤.二十二碳六烯酸和二十碳五烯酸研究进展(1)[J].生物学通报,2007,42(11):13-15. |
| 〔3〕 | Maruta T,Saito T,Inagaki M,et al.Biologically active glycosides from Asteroidea,41.Isolation and structure determination of glucocerebrosides from the starfish Linckia laevigata[J].Chem Pharm Bull,2005,53(10):1255-1258. |
| 〔4〕 | Hossain Z,Kurihara H,Hosokawa M,et al.Butyrate-induced growth inhibition and differentiation in Caco-2 cells with hybrid liposomes[J].J Oleo Sci,2005,54(5):281-288. |
| 〔5〕 | 肖辉,张月明,朱功兵,等.野蔷薇果提取物对不同肿瘤细胞抑制作用[J].中国公共卫生,2010,26(7):858-859. |
| 〔6〕 | Lamson SC,Kurnlin M,Ingelman-Sundberg M,et al.Dietary longchain n-3 fatty acids for the prevention of cancer:a review of potential mechanisms[J].Am J Clin Nutr,2004,79(6):935-945. |
| 〔7〕 | Fukunaga K,Hossain Z,Takahashi K.Marine phosphatidylcholine suppresses 1,2-dimethylhydrazine-induced colon carcinogenesis in rats by inducing apoptosis[J].Nutr Res,2008,28(9):635-640. |
| 〔8〕 | Hossain Z,Konishi M,Hosokawa M,et al.Effect of polyunsaturated fatty acid-enriched phosphatidylcholine and phosphatidylserine on butyrate-induced growth inhibition,differentiation and apoptosis in Caco-2 cells[J].Cell Biochem Funct,2006,24(2):159-165. |
| 〔9〕 | Wu D,Fujio M,Wong CH.Glycolipids as immunostimulating agents[J].Bio Org Med Chem,2008,16(3):1073-1083. |
| 〔10〕 | Shah AK,Kinoshita M,Kurihara H,et al.Glycosylceramides obtain from the starfish Asterias amurensis Lütken[J].J Oleo Sci,2008,57(9):477-484. |
 2012, Vol. 28
2012, Vol. 28