幽门螺杆菌(Helicobacter pylori,H.pylori)感染是慢性胃炎和消化性溃疡的重要致病因子,并与胃癌和胃粘膜相关淋巴样组织淋巴瘤(mucosa-associated lymphoid tissue lymphoma)的发生密切相关。WHO已将其列为胃癌的第Ⅰ类生物致癌因子〔1〕。H.pylori的世界平均感染率约为50%,中国成人感染率约为55%,其治疗主要采用由质子泵抑制剂、抗生素组成的三联或四联抗菌疗法〔2, 3〕。但随着抗生素的普遍应用,耐药菌株逐渐增多。疫苗接种为防治H.pylori感染最有效、最有前景的方法之一。目前已有成功构建球形H.pylori vacA基因重组表达质粒作为疫苗候选蛋白的报道〔4〕。热休克蛋白60(heat shock protein 60,HSP60)是H.pylori的主要免疫原之一,在H.pylori对胃上皮细胞的黏附、刺激机体产生免疫应答等方面起重要作用,且不同H.pylori菌株的HSP60氨基酸序列相对保守,是较理想的候选疫苗蛋白〔5〕。H.pylori HSP60的编码基因为groEL,本研究探讨构建GroEL基因的真核表达载体,为H.pylori核酸疫苗的研究提供参考依据。
1 材料与方法 1.1 材料(1)菌株与质粒:H.pylori ATCC 26695株(中国疾病预防预防控制中心传染病预防控制研究所传染病诊断研究室惠赠);pcDNA3.0及大肠埃希菌DH5α(滨州医学院病原生物学教研室保存)。(2)主要试剂与仪器:pMD19-T克隆载体、T4DNA连接酶、凝胶回收试剂盒、内切酶XhoⅠ和EcoR Ⅰ、Taq DNA聚合酶(宝生物工程(大连)有限公司);细菌基因组DNA提取试剂盒(杭州博日科技有限公司);3110三气培养箱(美国Thermo Scientific公司);Mastercycler Personal PCR仪(德国eppendorf公司);FluorChem FC2凝胶成像系统(美国Alpha Innotech公司)。
1.2 方法 1.2.1 基因组提取将H.pylori ATCC 26695接种于含10%绵羊全血的哥伦比亚琼脂平板上,置5% O2,10% CO2,85% N2的微需氧气体环境中37℃培养24 h,刮取1环菌苔,按照BioFlux细菌基因组DNA提取试剂盒说明书操作。
1.2.2 引物设计与合成根据GeneBank中H.pylori ATCC 26695菌株GroEL的核苷酸序列,利用Primer 5.0和DNAstar软件设计合成1对含有XhoⅠ和EcoRⅠ酶切位点的引物。P1:5'-CCGCTCGAGAGGCAAAAGAAATCAAATTTTC-3';P2:5'-CCGGAATTCTTACATCATGCCGCCCATGCC-3'。
1.2.3 GroEL基因扩增100 μL反应体系:10 × PCR buffer 10 μL,MgCl2(25 mmol/L)5 μL,dN TP (2.5 mmol/L)2.5 μL,P1(10 μmol/L)1.25 μL,P2(10 μmol/L)1.25 μL,H.pylori ATCC 26695基因组DNA 1.5 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,dH2O 78.0 μL。PCR反应条件:95℃预变性5 min;94℃变性1 min,61℃退火50 s,72℃延伸1.5 min,共30个循环;最后72℃延伸10 min,终止反应。扩增产物在1.2%琼脂糖凝胶上电泳,用凝胶回收试剂盒纯化回收PCR产物。
1.2.4 PCR产物TA克隆与验证将GroEL片段克隆至pMD19-T simple vector,挑选在含X-gal、IPTG及氨苄青霉素的琼脂平板上长出的白色菌落,PCR法初步筛选阳性克隆,经培养后提取质粒,用XhoⅠ和EcoRⅠ酶切鉴定,将挑选的克隆质粒送上海生工生物工程技术服务有限公司测序。
1.2.5 pcDNA3.0-GroEL重组质粒构建与验证提取pcDNA 3.0质粒和GroEL TA克隆质粒,分别用XhoⅠ和EcoRⅠ双酶切,1.2%琼脂糖凝胶上电泳,切胶回收酶切后的pcDNA3.0片段和GroEL片段,用T4DNA连接酶16℃过夜连接。将反应体系全部转化DH5α大肠埃希菌,涂布含氨苄青霉素的琼脂平板,PCR法初步筛选阳性克隆,经培养后提取质粒,用XhoⅠ和EcoRⅠ酶切鉴定。
2 结果 2.1 目的基因GroEL扩增产物以H.pylori ATCC 26695菌株基因组为模板的GroEL基因PCR扩增产物经1.2%琼脂糖凝胶电泳后,在约1 640 bp处可见到明显的扩增产物条带,未见非特异扩增条带,扩增产物与预测值相符。
2.2 TA克隆载体鉴定(图 1)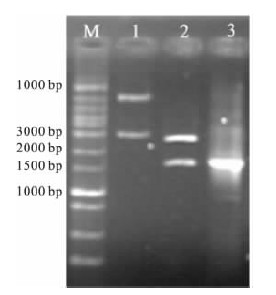 | 注: M: 1 000 bp plus DNA ladder marker; 1: 未经酶切的pMD19-TGroEL; 2: pMD19-T-GroEL XhoⅠ和EcoRⅠ双酶切; 3: pMD19-T-GroEL 的GroEL PCR 扩增产物。 图 1 pMD19-T-GroEL 的酶切及PCR 鉴定结果 |
克隆质粒经XhoⅠ和EcoRⅠ双酶切后,在1 640 bp处产生一明显条带,与GroEL基因PCR产物的大小一致;以pMD19-T-GroEL质粒为模板,经PCR扩增,在约1 640 bp处见到明显扩增产物条带。测序结果表明,获得的GroEL基因序列与GenBank报道的H.pylori ATCC 26695菌株GroEL的编码序列一致。由于XhoⅠ和EcoRⅠ的酶切位点已预先设计入上下引物P1、P2两端,表明GroEL基因已成功插入pMD19-T-GroEL质粒中。
2.3 重组质粒pcDNA3.0-GroEL的PCR及酶切鉴定(图 2)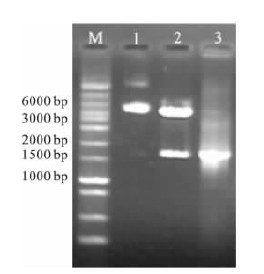 | 注: M: 1 000 bp plus DNA ladder marker; 1: 未经酶切pcDNA3. 0- GroEL; 2: pcDNA3. 0-GroEL XhoⅠ和EcoRⅠ双酶切; 3: pcDNA3. 0-Gro- EL 中GroEL 的PCR 扩增产物。 图 2 pcDNA3. 0-GroEL 的酶切及PCR 鉴定结果 |
pcDNA3.0-GroEL重组质粒经PCR扩增,获得了约1 640 bp的片段;pcDNA3.0-GroEL重组质粒经XhoⅠ和EcoRⅠ双酶切后,产生了1个与GroEL基因PCR产物大小一致的小片段和1个不同于pcDNA3.0-GroEL重组质粒的大片段,表明GroEL基因已成功插入pcDNA3.0质粒中。
3 讨论核酸疫苗是近几年应用分子生物学等新技术研制的一种新型疫苗,它的出现为防治人类感染性疾病带来了新希望。核酸疫苗是把外源基因克隆到真核表达载体上,然后将重组的质粒DNA直接接种到动物体内,使外源基因在活体内表达,产生抗原,激活机体的免疫系统引起免疫反应。核酸疫苗的优越在于:①能诱导体液免疫应答也能诱导细胞免疫应答;②诱导机体产生的免疫保护作用可持续较长时间,甚至产生终生免疫;③核酸疫苗本身是重组质粒,易纯化,安全,热稳定性好〔6〕。现有研究显示,H.pylori HSP60的单克隆抗体或肽段(VEGMQFDR GYLSPYF)结合佐剂免疫小鼠对H.pylori感染具有较好的免疫防治作用〔7〕。提示HSP60可能为H.pylori疫苗的较理想候选抗原。
本研究根据GeneBank公布的H.pylori ATCC 26695菌株GroEL基因的核苷酸序列,自行设计了引物,包含GroEL基因的整个开放读码框,并在引物的两端设计了与载体相适应的酶切位点,便于PCR产物的定向克隆和鉴定。实验以H.pylori ATCC 26695离株的基因组为模板,扩增得到GroEL基因片段。将GroEL基因插入到真核表达载体的多克隆酶切位点中,测序结果表明获得的GroEL基因序列与GenBank报道的ATCC 26695菌株GroEL的编码序列一致,表明真核表达载体构建正确,为进一步研究H.pylori核酸疫苗提供依据。
| 〔1〕 | Suganuma M,Kurusu M,Okabe S,et al.Helicobacter pylori membrane protein 1:a new carcinogenic factor of Helicobacter pylori[J].Cancer Res,2001,61:6356-6359. |
| 〔2〕 | Anagnostopoulos GK,Kostopoulos P,Margantinis G,et al.Omeprazole plus azithromycin and either amoxicillin or tinidazole for eradication of Helicobacter pylori infection[J].J Clin Gastroentero1,2003,36:325-328. |
| 〔3〕 | 刘泉,窦丹波.幽门螺杆菌感染与治疗现状[J].中华实用中西医杂志,2010,23(1):15-17. |
| 〔4〕 | 汪雪峰,王克霞,陈琳,等.球形幽门螺杆菌 vacA基因表达质粒构建及表达[J].中国公共卫生,2007,23(7):834-836. |
| 〔5〕 | Kamiya S,Osaki T,Taguchi H,et al.Immune response to heat shock protein of Helicobacter pylori-a candidate as a vaccine component[J].Keio J Med,2002,51(Suppl 2):24-25. |
| 〔6〕 | Henke A.DNA immunization-a new chance in vaccine research?[J]Med Microbiol Immunol(Ber1),2002,191:87-190. |
| 〔7〕 | Yamaguchi H,Osaki T,Kai M,et al.Immune response against a cross-reactive epitope on the heat shock protein 60 homologue of Helicobacter pylori[J].Infect Immun,2000,68(6):3448-3454. |
 2012, Vol. 28
2012, Vol. 28
