2. 哈尔滨医科大学;
3. 哈尔滨工业大学
膀胱癌是常见的泌尿系统恶性肿瘤。流行病学资料表明,摄入十字花科蔬菜能明显降低膀胱癌的发病风险〔1〕。莱菔硫烷(sulforaphane,SFN) 为异硫氰酸盐(isothiocyanates,ITCs) 衍生物,广泛存在于十字花科植物中,在西兰花中含量最多,是蔬菜中防癌抗癌效果较好的天然活性物质之一〔2〕。 循环浓集实验及人群志愿者实验表明,机体尿液对摄入体内的莱菔硫烷有强大的蓄积能力,提示莱菔硫烷对膀胱上皮的癌症有明显的拮抗作用。目前,国内外关于莱菔硫烷与膀胱癌之间的研究资料较少。近年研究发现,环氧化酶(cyclooxygenase-2,COX-2) 的过表达与移行型膀胱癌的发展、预后以及复发都密切相关〔3〕。研究认为,ITCs 作用于细胞发挥作用,与丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK) 和磷脂酰肌醇(-3) 激酶(phosphatidylinositol 3-kinase,PI3K) 信号途径有关〔4〕。本研究探讨MAPKs 和PI3K 信号途径在SFN 抑制膀胱癌增殖、COX-2 表达中的作用,为食源性癌症化学预防剂的开发应用提供理论依据。
1 材料与方法 1.1 细胞培养人膀胱移行上皮癌细胞T24,取自Ⅲ级膀胱癌移行细胞癌组织,购自中科院上海生命科学研究院细胞库。
1.2 试 剂莱菔硫烷(美国LKT 有限公司) 。TRIzol Total RNA Isolation 试剂盒(美国Gibco BRL 公司) 、RNA 提取试剂 (TRIZOL,美国Invitrogen 公司) ; 其他试剂(美国ABI 公司) ; 逆转录试剂盒Primescript TM RT Reagent Kit(大连宝生物公司) ; Real-time PCR 所用探针、引物由美国Sigma 公司合成。c-Jun 氨基端激酶(c-jun NH2-terminal kinase,JNK) 特异抑制剂(SP600125) 、MAPK 激酶/胞外信号调节激酶(MAPK kinase /extracellular signal-regulated kinase,MEK/ERK) 抑制剂 (PD98059) 、p38 抑制剂(SB202190) 和PI3K 抑制剂 (LY294002) (英国TOCRIS 公司) 。
1.3 实验方法 1.3.1 细胞培养人膀胱癌T24 细胞在含有10% 小牛血清、 100 U/mL 青霉素、100 μg /mL 链霉素和2 mmol /L L-谷氨酰胺的RPMI 1640 培养基中,于37 ℃、5%CO2 培养箱中常规培养。细胞每2 d 换1 次培养液,3 ~ 4 d 传1 代。
1.3.2 细胞增殖实验取处于对数生长期的T24 细胞常规消化,用10%RPMI 1640 完全培养液配制成7 × 104 个/mL 细胞悬液。每孔接种100 μL 细胞悬液,每个浓度设4 个平行样。在37 ℃、5%CO2 培养箱中培养过夜。吸出培养液,每孔加入含有0、5、10、20 μmol /L 的SFN RPMI1640 培养液200 μL,在37 ℃、5%CO2 培养箱培养1 ~ 7 d。从给处理开始每天取1 块96 孔按前述方法测定其吸光度值。在第3 d 结束时,更换含有相同浓度的SFN 的完全培养液直至实验结束。
1.3.3 总RNA 提取总RNA 提取采用GenEluteTM Mammalian RNA kit(美国Sigma 公司) 进行测定,按说明书进行操作。RNA 浓度和纯度测定采用NanoDrop 进行测定。RNA 比值> 1.9 方可用于下一步实验。
1.3.4 逆转录和实时定量PCR 1.3.4.1 标准曲线绘制主要步骤如下: (1) 样品稀释: 用 PCR 水将样品先做1∶ 10 和1∶ 100 两个倍数稀释。然后依次再用PCR 水做系列稀释; (2) 在PCR 室中上样(96 孔板) ,每孔10 μL。(3) 配置反应混合体系(reactions,rxns) 和PCR 扩增。(4) 计算PCR 效率。
1.3.4.2 逆转录采用Primescript TMRT Reagent Kit 进行。 总RNA 提取采用GenEluteTM Mammalian RNA kit(美国Sigma 公司) 进行测定,按说明书进行操作。反转录和PCR 按照日本TaKaRa 公司试剂盒操作。COX-2 正向引物: 5'-GAA TCA TTC ACC AGG CAA ATT G-3',反向引物下: 5'-TCT GTA CTG CGG GTG GAA CA-3',探针: 5'-TCC TAC CAC CAG CAA CCC TGC CA complement-3'。试验结果通过2-ΔΔCt 方法计算诱导倍数。公式如下: ΔΔCt = (Ctt, arget-C t,185s) Timex-(Ct,target-Ct,185) Time0 ; Flod = 2-ΔΔCt。
1.4 统计分析应用SPSS 13.0 统计软件进行数据分析,多组之间的比较采用ANOVA 方差分析,多组与对照组之间的比较采用Dunnett(q') 检验,P < 0.05 为差异有统计学意义。
2 结 果 2.1 SFN 对膀胱癌T24 细胞生长的抑制作用(图 1)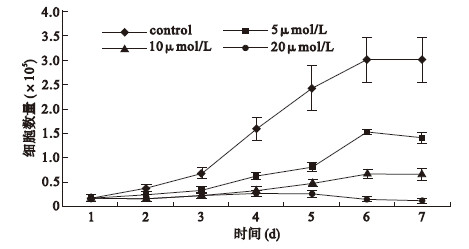 | 图 1 莱菔硫烷对膀胱癌细胞增殖影响 |
对照组细胞在第1d 开始生长速度就快于其他处理组细胞,在第3d 进入指数生长期。而SFN 处理的各组细胞则生长缓慢,在整个实验期间内未进入指数生长期。20μmol /L SFN 几乎完全抑制细胞增殖,并且在第5d 后细胞数已低于接种时数量。
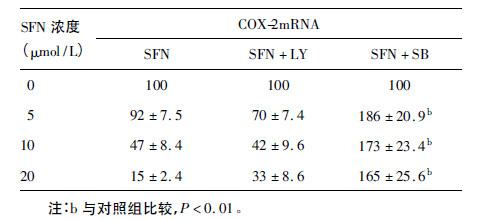
2.2 莱菔硫烷对COX-2 m RNA 表达的影响(表 1)| 表 1 莱菔硫烷对COX-2 mRNA 表达影响 |
用5 ~ 10 μmol /L SFN 处理T24 细胞10 h 和24 h 后。结果表明,SFN 能以剂量依赖方式明显抑制COX-2 mRNA 的表达,SFN 作用 T24 细胞10 h 后对COX-2 mRNA 的抑制作用更明显。
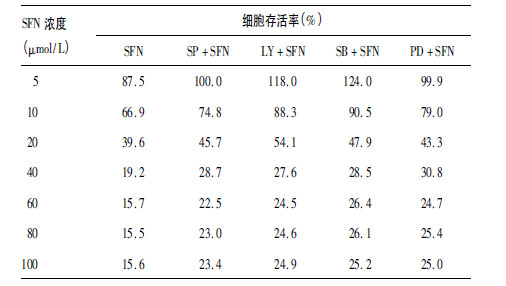
2.4 MAPK 激酶和PI3K 激酶在SFN 抑制T24 细胞增殖中的作用(表 2)| 表 2 MAPKs 和PI3K 抑制剂在SFN 抑制细胞增殖中的作用 |
本研究分别选用了3 条MAPKs 信号激酶抑制剂分别为: JNK 特异抑制剂(SP600125) 、MEK/ERK 抑制剂 (PD98059) 、p38 抑制剂(SB202190) 和PI3K 抑制剂 (LY294002) 。结果表明,4 种抑制剂均能在不同程度上影响 SFN 抑制T24 细胞增殖的作用。根据表 2 结果计算得到的半数抑制浓度(IC50) ,SFN 为(16.1 ± 0.62) 、,当用MAPKs 的3 个特异性抑制剂以及PI3K 抑制剂后,IC50 值均有一定得升高,其中,LY294002 和SB202190 抑制剂阻断后,能明显升高 SFN 的半数抑制浓度[(分别升高为(28.7 ± 2.45) 和(29.8 ± 1.84) ,与SFN 组比较,P < 0.01) ],说明p38 抑制剂和PI3K 抑制剂在SFN 抑制T24 细胞增殖中发挥重要作用。
2.5 p38MAPK 和PI3K 抑制剂在SFN 抑制COX-2 表达中的作用(表 3)| 表 3 p38MAPK 和PI3K 抑制剂在莱菔硫烷抑制 COX-2 表达中作用 |
分别用10 μmol /L LY294002 和10 μmol /L SB202190 处理T24 细胞1h 后,再换成含有0 ~ 20 μmol /L SFN 的培养液继续培养24 h。结果表明,LY294002 和 SB202190 对COX-2 mRNA 的作用不同。LY294002 不能阻断 SFN 对COX-2 mRNA 的抑制作用,而SB202190 则明显阻断了 SFN 对COX-2 mRNA 的抑制作用,甚至是完全逆转了SFN 对 COX-2 mRNA 的抑制作用。提示p38MAPK 激酶信号途径在 SFN 抑制COX-2 mRNA 表达的过程中起主要作用。
3 讨 论莱菔硫烷是已经被证实具有防癌抗癌活性的异硫氰酸盐衍生物之一。本研究发现,3 条MAPKs 信号途径特异的激酶抑制剂和PI3K 激酶抑制剂在不同程度上影响SFN 抑制T24 细胞增殖的作用,而且p38MAPK 通路在SFN 抑制COX-2mRNA 表达过程中起重要作用。
MAPK 信号途径和PI3K 信号途径是调控细胞增殖、细胞周期和细胞凋亡的经典途径〔4〕。目前认为,p38 激酶通路在炎症反应、细胞生长、细胞分化和细胞死亡诸多过程中起关键作用〔5, 6〕。与p38 在炎症反应中的特殊作用相同,COX-2 也在其中扮演重要角色。当细胞受到脂多糖(lipopolysaccharide,LPS) 、炎性因子、生长因子和致癌剂的刺激后,COX-2 才被诱导。COX-2 是花生四烯酸合成前列腺素(prostaglandin,PG) 的限速酶,在抑制免疫功能、抑制细胞凋亡、引起细胞过度增生甚至增加癌细胞的侵袭性等方面发挥关键作用〔7〕。因此,COX-2 已成为癌症治疗和预防的关键靶点〔7, 8〕。
本研究结果表明,PI3K 信号途径和p38MAPK 信号途径在SFN 抑制T24 细胞增殖中起关键作用,而p38MAPK 信号途径还在SFN 抑制COX-2 mRNA 的表达中发挥关键作用。 提示p38MAPK 是SFN 发挥抗癌作用中的重要靶点之一,该研究结果为深入探讨SFN 的抗癌作用机制提供了新的思路。
| 〔1〕 | Choi S,Singh SV.Bax and bak are required for apoptosis induction by sulforaphane,a cruciferous vegetable-derived cancer chemopreventive agent[J].Cancer Res,2005,65:2035-2043. |
| 〔2〕 | Hu R,Hebbar V,Kim BR,et al.In vivo pharmacokinetics and regulation of gene expression profiles by isothiocyanate sulforaphane in the rat[J].J Pharmacol Exp Ther,2004,310:263-271. |
| 〔3〕 | Klein RD,Van Pelt CS,Sabichi AL,et al.Transitional cell hyperplasia and carcinomas in urinary bladders of transgenic mice with keratin 5 promoter-driven cyclooxygenase-2 overexpression[J].Cancer Res,2005,65:1808-1813. |
| 〔4〕 | Keum YS,Jeong WS,Kong AN.Chemoprevention by isothiocyanates and their underlying molecular signaling mechanisms[J].Mutat Res,2004,555(1-2):191-202. |
| 〔5〕 | 穆润清,贺安宁,王丽,等.MAPK和MPF对小鼠受精卵有丝分裂期作用[J].中国公共卫生,2006,22(5):594-595. |
| 〔6〕 | 杨学森,龚茜芬,张广斌,等.电磁辐射对大鼠海马MAPK信号通路的影响[J].中国公共卫生,2005,21(6):693-695. |
| 〔7〕 | 卢长伟,董家鸿.COX-2在恶性肿瘤血管生成中作用机制的研究进展[J].军医进修学院学报,2007,28(4):310-311. |
| 〔8〕 | 陈静君,任宏.COX-2选择性抑制剂的抗肿瘤作用研究进展[J].中国药房,2007,18(19):1508-1509. |
 2012, Vol. 28
2012, Vol. 28