2. 广州市第八人民医院
登革病毒(dengue virus,DEN) 属黄病毒属〔1〕,为单股正链RNA 病毒〔2〕,可导致登革热和登革出血热。登革病毒病流行于热带和亚热带地区,每年约有5 000 万至1 亿人感染,已成为全球公共卫生关注的焦点之一〔3〕。登革热的诊断目前主要依赖病毒分离培养以及血清中特异性IgM、IgG 抗体测定,但是所耗时间长,在早期诊断中受到一定限制〔4〕。而常规PCR 方法扩增产物需要凝胶电泳检测,易造成实验室交叉污染。本研究拟建立可对登革1 型病毒感染进行早期诊断的更省时、特异的荧光定量PCR 方法。现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 病毒株与临床标本登革病毒1-4 型毒株标准株 (DEN-1 夏威夷株、DEN-2 新几内亚株、DEN-3-H87 株和DEN-4-H241 株,均由本实验室保存) ; 登革1 型病毒感染者临床标本(广州市第八人民医院) ; 乙型脑炎减毒活疫苗(成都生物制品研究所) 。
1.1.2 主要试剂与仪器普通PCR 反应试剂、荧光定量 PCR 试剂、RNA 提取试剂盒、反转录试剂盒(大连TAKARA 宝生物公司) 。Mx3005p 荧光定量PCR 仪(美国Stratagene 公司) 。
1.2 方法 1.2.1 引物探针设计从GenBank 中下载80 株不同年份和不同地区的登革1 型病毒基因组全序列,登革2、3、4 型病毒以及黄病毒属其他病毒均分别下载10 株,用Clustal W 进行比对,寻找保守序列。使用BeaconDesigner 7.0 软件设计引物探针,由大连TAKARA 宝生物公司负责合成。上游引物: 5'-GATGAGATCCAG ATGGAGTAGAAAG-3'; 下游引物: 5'-TCAGTTGTCCCATTATAAGAAGGAG-3'; 探针: 5'FAM-ACAGCCAGTGTTCCAGTCATCAGCA-Eclipse3'。保守基因(80bp,位于编码非结构蛋白基因NS2A 处) 由Takara 公司合成至 pMD18-T 载体中,命名为PMDns2a。登革病毒总引物探针参见文献〔5〕。常规PCR 登革1 型引物参见文献〔6〕。
1.2.2 荧光定量PCR 扩增反应(1) 反应体系: 取2 μL DNA,上、下游引物、探针、参比染料Rox reference Dye II 各 0.5 μL,Ex taq 酶预混液12.5 μL,加去离子水至总反应体积 25 μL。扩增条件: 95 ℃ 30 s 预变性; 95 ℃ 5 s 变性、60 ℃ 20 s 退火延伸,40 个循环。(2) 引物与探针最佳浓度优化: 以相同浓度质粒为反应模板,引物浓度(10 μmol /L) 不变,引物量从0.2 ~ 0.6μL 以0.1 μL 递增; 探针浓度(3 μmol /L) 不变,探针量从0.2 ~ 0.7 μL 以0.1 μL 递增; 采用矩阵法优选引物和探针的最佳浓度。
1.2.3 标准曲线的制备提取质粒PMDns2a 并且线性化后 10 倍倍比稀释,依次从1010 copies /mL 稀释到104 copies /mL。 各取2 μL 进行荧光定量PCR,用去离子水做空白对照。
1.2.4 荧光定量PCR 特异性、重复性、敏感性试验参照文献〔7〕,用建立的荧光定量PCR 方法对登革1-4 型病毒标准株以及乙型脑炎减毒活疫苗株进行检测。线性化后的 PMDns2a 质粒10 倍倍比稀释6 个浓度,从1.01 × 107 稀释到 1.01 × 102 copies /μL,分不同的时间重复3 次,每次做3 个重复孔,验证重复性和再现性,变异系数(即相对标准偏差 RSD) 需< 25%〔8〕。此外,对PMDns2a 质粒进行10 倍倍比稀释,荧光定量PCR 检测比较其敏感性。
1.2.5 临床标本检测对广州市第八人民医院提供的cDNA 标本进行荧光定量PCR 检测,用登革病毒总引物探针进行验证,并且根据Ct 值对荧光定量PCR 方法以及常规PCR 方法进行比较。荧光定量PCR 检测以Ct 值< 37 并且扩增曲线呈 S 型为阳性判定原则〔9〕。其中Ct 值< 35 且扩增曲线良好可直接判定为阳性,Ct 值为35 ~ 37 需要重复实验。2 次实验均能得到良好S 型扩增曲线方可判定为阳性。根据该标准可确定检测标本是否为阳性,并且可计算阳性率。参照文献〔10〕 将Ct 值分为4 类对结果进行分析,即< 25,25 ~ 29.9,30 ~ 34.9,≥35。
1.3 统计分析应用SPSS 13.0 软件进行统计分析。配伍组资料采用随机区组设计资料的方差分析(two-way ANOVA) ,P < 0.05 为差异有统计学意义。
2 结果 2.1 引物与探针浓度优化上、下游引物的量分别为0.2、 0.3、0.4、0.5、0.6μL; 探针量为0.2、0.3、0.4、0.5、0.6、0.7 μL。通过对同一浓度模板、不同浓度引物和探针的扩增结果进行比较,发现当探针量和引物量均为0.5 μL 时,Ct 值最小,荧光强度增加值(△Rn) 较高,故本实验采用引物量和探针量均为0.5 μL。
2.2 标准曲线制备荧光定量PCR 标准曲线相关系数R2 = 0.999,扩增效率Eff = 96.5%,回归方程Y =-3.410logX + 45.10(Y 为Ct 值,X 为模板浓度) ,表明标准曲线的Ct 值与初始浓度有较好的线性关系。
2.3 特异性对登革1 型病毒提取核酸的扩增结果为阳性,而对其他3 型登革病毒以及乙型脑炎病毒提取核酸的扩增结果均为阴性,表明所建立的针对登革1 型病毒的荧光定量 PCR 方法不会受到其他3 型登革病毒和乙型脑炎病毒干扰。
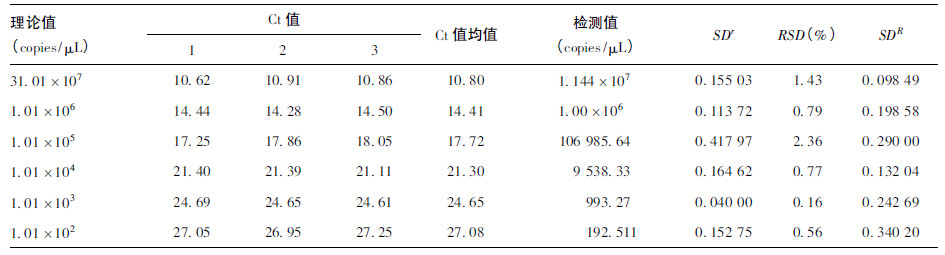
2.4 重复性和再现性(表 1、2)| 表 1 重复性测量结果统计分析 |
| 表 2 不同浓度的Ct值均值及变异系数 |
结果表明,配伍设计有效 (F = 2 539.037,P < 0.001) ; 而3 个重复孔之间结果无明显差异(F = 0.814,P = 0.471) 。各个浓度的Ct 值均值及变异系数分析结果表明,重复性标准差(SDr ) 为0.04 ~ 0.42,再现性标准差(SDR ) 为0.098 ~ 0.29,变异系数< 2.5%,方法具有良好的重复性和再现性。
2.5 敏感性本研究建立的荧光定量PCR 方法检测,敏感性可达到1 copy /μL。
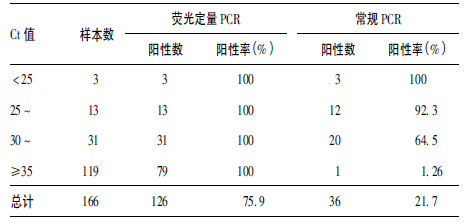
2.6 临床标本的检测(表 3)| 表 3 临床标本不同检测方法的比较 |
采用登革病毒种特异引物探针和本研究建立的登革1 型病毒型特异引物探针对166 份 cDNA 样本进行荧光定量PCR 检测,均发现126 份为阳性,阳性率均为75.9%,Ct 值为20.84 ~ 36.36,浓度范围为1 ~ 1.3 × 104 copies /μL; 常规PCR 方法检测到其中36 份为阳性,阳性率为21.7%。表明设计的引物探针对登革1 型病毒检测的敏感性和特异性较高,可适用于临床样本的早期快速检测。
3 讨论本研究通过对4 个血清型的登革病毒基因组序列同源性分析,发现登革1 型病毒在非结构蛋白基因NS2A 处有一段 80bp 的保守序列,而且该段基因序列与登革病毒其他3 型及其他黄病毒属之间存在较大差异。设计的引物探针经研究证实与其他3 型病毒及乙脑病毒间不存在交叉反应,显示出较高特异性,而且敏感性可达1copy /μL,与Isabelle〔7〕的报导结果接近。验证试验的Ct 值差异小,表明该方法稳定性较好。 以阳性质粒制作的标准曲线回归方程Y =-3.410logX + 45.10,相关系数R2 = 0.999,扩增效率EfF = 96.5%,可根据此标准曲线对样品中的登革1 型病毒进行绝对定量。
利用本研究设计的荧光定量PCR 方法对临床标本进行了检测。在166 份标本中,检测出126 份为阳性,而常规PCR 方法只检测出36 份,可见荧光定量PCR 法比常规PCR 法更加灵敏,而且常规PCR 法从病毒核酸提取、逆转录、PCR 反应与电泳,整个过程大约需6 ~ 7 h,而采用本方法仅需3 h 左右,能同时完成多个样本的高通量检测,可实现对临床疑似病例的早期快速检测和鉴别诊断,并具有快速、敏感、特异并可对标本中病毒进行定量的优点。
| 〔1〕 | 贡树基,赵卫,曹虹,等.登革2型病毒全长基因组的长链RTPCR法扩增[J].中国公共卫生,2006,22(4):429-430. |
| 〔2〕 | 周永兵,左丽,刘伟,等.不明原因发热病人血清中登革病毒核酸检测[J].中国公共卫生,2008,24(5):623-624. |
| 〔3〕 | Halstead SB.Dengue[J].Lancet,2007,370:1644-1652. |
| 〔4〕 | David M,Morens MD.Dengue fever and dengue hemorrhagic fever [J].The Pediatric Infectious Disease Journal,2009,28:635-636. |
| 〔5〕 | 姚锦绣,赵卫,张玲,等.实时荧光PCR技术检测登革病毒的研究[J].华西医学,2009,24(4):912-914. |
| 〔6〕 | Tanaka M.Rapid identification of flavivirus using the polymerase chain reaction[J].Journal of Virological Methods,1993,41:311-322. |
| 〔7〕 | Leparc-Goffarta I,Baragatti M,Temmam S,et al.Development and validation of real-time one-step reverse transcription-PCR for the detection and typing of dengue viruses[J].Journal of Clinical Virology,2009,45:61-66. |
| 〔8〕 | Yang L,Zhang H,Guo J,et al.International collaborative study of the endogenous reference gene LAT52 used for qualitative and quantitative analyses of genetically modified tomato[J].Agricultural and Food Chemistry,2008,56(10):3438-3443. |
| 〔9〕 | 朱水荣,张政,卢亦愚,等.嗜肺军团菌荧光定量PCR检测[J]. 中国公共卫生,2008,24(9):1111-1113. |
| 〔10〕 | Ito M,Takasaki T,Yamada K,et al.Development and evaluation of fluorogenic taqMan reverse transcriptase PCR assays for detection of dengue virus types 1 to 4[J].Journal of Clinical Microbiology, 2004,42(12):5935-5937. |
 2012, Vol. 28
2012, Vol. 28