2.河南科技大学食品与生物工程学院
黄曲霉毒素是黄曲霉菌( Aspergillus flavus) 和寄生曲霉菌( Aspergillus parasiticus) 产生的一组结构类似的代谢产物,是特剧毒生物毒素,具有致畸、致癌、致诱变作用,属于I 类致癌物,主要诱发肝癌〔1, 2〕。Aflatoxin B1 ( AFB1 ) 广泛存在于粮食、畜禽饲料中,因此对AFB1 残留开展有效的快速检测很有意义。WHO、FAD、欧盟、美国等均对AFB1 限量制定明确要求,我国也确定了AFB1 的检测量〔3〕。目前已建立的AFB1 检测方法有薄层色谱法( thin-layer chromatography ,TLC) 、高效液相色谱、免疫亲和柱荧光光度法、酶联吸附法( enzymelinked immunosorbent assay,ELISA) 、金标法、微柱筛选法等。 这些方法要求对样品进行较繁琐前处理,需要昂贵的仪器并耗费大量人力,无法进行大范围推广。因此本研究建立免疫学定理分析方法,为快速检测提供更好的检测方法。
1 材料与方法 1.1 材料 1.1.1 试剂AFB1 ( 德国Sigma 公司,纯度≥98.0%) ; N-羟基琥珀酰亚胺( N-hydroxysuccinimide,NHS) [吉尔生化( 上海) 有限公司]; 羊抗鼠酶标二抗( goat anti-mouse IgG antibody,GaMIgG-HRP) ( 华美生物工程有限公司) ; 黄曲霉毒素B1-羧甲基肟 ( AFB1-C3-carboxymethyloxime,AFB1O) ,牛血清白蛋白( bovine serum albumin,BSA) ,鸡卵清蛋白( ovalbumin,OVA) ,AFB1-BSA 偶联物( 免疫抗原) 和AFB1-OVA 偶联物( 包被抗原) 等为自制; 其他试剂市售所得,均为AR 级。
1.1.2 溶液洗液( phosphate buffered saline tween,PBST) 为 0.01 mol /L、pH 7.4 的磷酸盐缓冲液( phosphate buffered saline,PBS) 含0.05% Tween-20; 包被液为0.1 mol /L pH 9.6 的碳酸盐缓冲液( carbonate buffer solution,CBS) ; 封闭液、稀释液为含5%猪血清的PBST; 酶底物为四甲基联苯胺( tertramethylbenzidine,TMB) 的磷酸-柠檬酸缓冲液; 终止液为2 mol / L 的硫酸溶液。
1.1.3 主要仪器3K-18 高速冷冻离心机( 德国Sigma 公司) ; 超净工作台( 美国Forma Scientific 公司) ; HI9321 酸度计 ( 美国HANNA 公司) ; U-3000 紫外扫描仪( UV) ( 日本岛津公司) ; Bio-Rad-550 型酶标仪( 美国Bio-Rad 公司) 。
1.1.4 实验动物和细胞SPF 级6 周龄雌性BALB/C 小鼠 [许可证号: SYXK( 豫) 2011-0001],购自郑州大学医学院实验动物中心,由河南省动物免疫学重点实验室饲养。NS0 骨髓瘤细胞由英国国家动物健康研究院惠赠。
1.2 方法 1.2.1 AFB 免疫原制备AFB1-O 的制备根据文献〔4, 5〕报道的原理,参考陈福生等〔6〕方法。AFB1-O 与BSA 的偶联: 采用DCC 法合成AFB1O-BSA 人工全抗原〔7, 8〕。
1.2.2 BALB/C 小鼠免疫程序和方法取高压PBS 溶解 AFB1-BSA 至50 μg /mL,与等量FCA 混合,充分乳化后免疫6 周龄BALB/c 小鼠3 只/组,免疫2 组,免疫剂量为每只0.2 mL,免疫方式为背部皮下6 点注射。
1.2.3 筛选方法的建立棋盘法〔9〕确定包被抗原的最佳浓度,然后按照常规间接ELISA 方法对免疫小鼠血清和杂交瘤细胞培养上清进行检测。
1.2.4 细胞融合和克隆细胞融合: 间接ELISA、间接竞争 ELISA 挑选效价最高、IC50 最低的小鼠为细胞融合备用鼠,采用50 ug /只的免疫剂量进行腹腔注射式超强免疫。杂交瘤细胞的筛选与克隆: 融合后待细胞,通过间接ELISA 和阻断 ELISA 进行阳性孔筛选,选择强阳性、抑制率高的克隆化,之后扩大培养、建株、反复冻存与复苏,从而保证单克隆细胞分泌抗体的稳定性。
1.2.5 单克隆抗体的制备及提纯单克隆抗体的制备: 采用体内诱生法〔10〕大量制备AFB1 单克隆抗体( AFB1mAb) 。单克隆抗体腹水提纯: 采用辛酸-硫酸铵法〔11〕提纯腹水,提纯后进行SDS-聚丙烯酰胺凝胶电泳( SDS-PAGE) ,检测纯化效果。
1.2.6 单抗免疫学特性鉴定 1.2.6.1 效价测定采用间接ELISA〔12〕测定细胞株上清与腹水的效价。
1.2.6.2 亲和力鉴定参照Jibin〔13〕所述方法测定亲和常数 Ka。用浓度分别为0.1 μg /mL 和0.05 μg /mL 的AFB1-BSA 包被,加入倍比稀释的AFB1mAb,再加入GaMIgG-HRP,TMB 显色测A450 nm 值,以AFB1mAb 浓度为横坐标,以A450 nm 值为纵坐标,绘出相应的2 条反应曲线,以每条曲线上部平坦段的 A450 nm 值作为100%,在曲线上算出50% A450 nm 值时对应的AFB1 mAb 浓度,按照以下公式计算亲和常数 Ka,其中n =[Ag]t / [Ag']t,[Ag]t、[Ag']t 为2 个不同的包被原浓度,[Ab]t、[Ab']t 为包被原浓度对应的抗体浓度。

用PBS 配置不同浓度AFB1 的标准品,用间接竞争ELISA 测定AFB1mAb 对其抑制率。以抑制率B/B0 为纵坐标( B 是AFB1 不同标准浓度的A450 值,B0 是 AFB1O 标准浓度的A450 值) ,以不同浓度AFB1 的对数值为横坐标,绘制标准抑制曲线,进行相关回归分析,计算AFB1mAb 对AFB1 的IC50。
1.2.6.4 特异性鉴定以AFB1 的同类药物以及其他类药物作为竞争物,用间接竞争ELISA 测定单抗对各竞争物的 IC50。以单抗对AFB1 的IC50 与各竞争物的IC50 的百分比为其交叉反应率( cross activity,CR%) 。
1.2.6.5 亚型的鉴定采用间接ELISA 方法,按鉴定试剂盒说明进行检测。
1.2.7 定量ELISA 方法的建立 1.2.7.1 标准曲线建立最佳的包被浓度采用棋盘实验确定,分别通过单因素实验,确定一抗稀释浓度、酶标二抗稀释浓度,并绘绘制标准曲线。
1.2.7.2 交叉反应以最佳AFB1-OVA 浓度包板,分别取 AFB2、ZEN、赫曲霉毒素等多种真菌毒素做交叉,按1.2.3 方法测定A450 ,B/B0( %) 为纵坐标,表示对应浓度的药物对抗 AFB1 单抗的抑制率,以各种药物浓度的对数值为横坐标,绘制以上各毒素的竞争抑制曲线,求出回归方程,根据下面公式求出AFB1 与其他真菌毒素的交叉反应率:
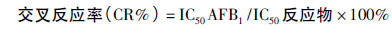
将肟化后沉淀物做TLC,Rf = 0.8 处是AFB1 ,Rf = 0.2 处为肟化产物AFB1O。
2.1.2 UV 鉴定结果利用U-3000 紫外扫描仪在220 ~ 44 nm 波长范围进行扫描,结果表明BSA 的最大吸收峰在278 nm,AFB1 在265、365 nm 处有吸收峰,BSA 与AFB1 偶联后,两峰叠加在275、365 nm 附近出现吸收峰,表明偶联成功。
2.1.3 SDS-PAGE 鉴定结果SDS-PAGE 电泳结果表明,BSA 的泳动速度大于AFB1-BSA,说明AFB1-BSA 的分子量大于 BSA,证明AFB1 已分别与BSA 成功偶联。
2.2 ELISA 最佳反应条件AFB1-OVA 的最佳包板浓度为2 μg /mL,酶标二抗的工作浓度为1: 1 000,孵育时间为30 min,孵育温度为37 ℃。
2.3 小鼠血清效价、敏感性测定结果免疫的3 只小鼠血清抗体效价均达到了10-4 ,获得了较好的免疫效果,3 号鼠血清效价最高; 3 号鼠的IC50 最低,达到58.923 ng /mL,线性回归方程为y =-0.216 6 x + 0.563 5,相关系数R2 = 0.987,符合线性关系的判定标准,故选择3 号鼠为细胞融合备用鼠。
2.4 免疫学特性及定量分析建立 2.4.1 最佳包被浓度( 表 1)| 表 1 间接ELISA 结果 |
可确定最佳包被原1: 3 200 倍稀释时,抗体稀释倍数为1: 16 000。
2.4.2 效价测定结果将筛选出符合要求的杂交瘤细胞,以其细胞分泌液的效价高低为依据。将AFB1mAb 具有较高的效价细胞挑选出,其中2H5C9 细胞株的上清效价最高为 1: 1.28 × 105 ,以此细胞株做为制作腹水效价的细胞株。
2.4.3 亲和力测定结果( 图 1) | 图 1 AFB1 mAb 的亲和常数测定曲线 |
2H5C9 所分泌的mAb 与抗原结合达到饱和的50%所需mAb 的浓度分别为0.536、0.273 μg /mL,其亲和力常数Ka 为2.65 × 1010 L/mol。依据James 等〔14〕结论,亲和常数为107 ~ 1012 L/mol 抗体亲和力高,本试验制备的mAb 亲和力较高,适合于ELISA 方法检测。
2.4.4 敏感性鉴定结果H5C9 杂交瘤的AFB1mAb 曲线回归方程为: y =-0.428 6 x + 1.309 8,相关系数为R2 = 0.9732,根据回归方程计算出2H5C9 对AFB1 的IC50 为2.58 ng /mL,本试验所获mAb 对AFB1 具有很好的敏感性。
2.4.5 特异性鉴定AFB1 mAb 的IC50 为0.58 ng /mL,与黄曲霉毒素B2 的交叉反应率为1.61%,与其他药物的交叉反应率均< 0.05%,表明AFB1 与mAb 特异性结合很强,AFB1mAb 对AFB1 及其同系物有较好的特异性。
2.5 亚型的鉴定结果通过Pierce 公司ELISA 检测试剂盒鉴定,AFB1mAb 的亚型均为IgG1。
3 小结免疫学定量分析方法的建立,主要通过竞争ELISA 法测定AFB1 mAb 的效价,阻断ELISA 法测定AFB1 mAb 半数 IC50 ,通过添加回收测定AFB1mAb 灵敏性,还有AFB1mAb 特异性,与其他药品的交叉反应率等实验来进行AFB1mAb 的免疫学鉴定。
本次实验筛选出2H5-F6、2H5-C9、2H9-C3 三株细胞,其细胞培养上清效价在1: 2.0 × 102 ~ 1: 1.28 × 103 ,其中2H5-F6 细胞株制作的腹水效价为1: 1.28 × 106 ,AFB1mAb 亲和常数 Ka 为2.65 × 1010 L/moL,对AFB1 的IC50 为2.58 ng /mL; 与黄曲霉毒素B2 的交叉反应率为1.61%,与其他类药物无交叉反应。实验制备的单抗完全满足检测要求,为以后研制快速检测黄曲霉毒素B1 试剂打下了基础,拓宽了ELISA 方法应用范围。
| 〔1〕 | Dskovic A,Matijasevic S,Rottinghausge GE,et al.Aflatoxin B1 adsorption by natural and copper modified montmorillonite[J]. Colloids Surf B Biointerfaces,2008,66(1):20-25. |
| 〔2〕 | Meissonnier GM,Pinton P,Laffitte J,et al.Immunotoxicity of aflatoxin B1:impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression[J].Toxicol Appl Pharmacol,2008,231(2):142-149. |
| 〔3〕 | 王颖,刘阳,周立波,等.磺胺二甲嘧啶竞争抑制ELISA法检测 [J].中国公共卫生,2008,24(12):1497-1498. |
| 〔4〕 | Chu FS,Ueno I.Production of antibody against aflatoxin B1[J]. Appl Environ Microbiol,1977,33(5):1125-1128. |
| 〔5〕 | Wang G,Mu J,Wang D,et al.Production and characterization of monoclonal antibody against aflatoxin B1[J].Hua Xi Yi Ke Da Xue Xue Bao,1995,26(3):275-278. |
| 〔6〕 | 陈福生,周启,罗信昌,等.黄曲霉毒素B1抗独特型抗体的制备和应用研究I抗独特型抗体的制备和性质研究[J].菌物学报,2004(1):93-101. |
| 〔7〕 | Paknejad M,Javad Rasaee M,Mohammadnejad J,et al.Development and characterization of enzyme-linked immunosorbent assay for aflatoxin B1 measurement in urine sample using penicillinase as label[J].J Toxicol Sci,2008,33(5):565-573. |
| 〔8〕 | Shim WB,Yang ZY,Kim JS,et al.Development of immunochromatography strip-test using nanocolloidal gold-antibody probe for the rapid detection of aflatoxin B1 in grain and feed samples[J].J Microbiol Biotechnol.2007,17(10):1629-1637. |
| 〔9〕 | 陈金玉,李旭红.简易棋盘表的制作及在数量性状遗传中的运用[J].生物学通报,2007,42(7):25. |
| 〔10〕 | Qing L,Wu J,Qi Y,et al.Production of monoclonal antibodies to broad bean wilt virus and application in virus detection[J].Wei Sheng Wu Xue Bao,2000,40(2):166-173. |
| 〔11〕 | 余鹏博,王敬军,张家驹,等.汉坦病毒核蛋白原核表达纯化及其单抗制备[J].中国公共卫生,2008,25(12):1445-1447. |
| 〔12〕 | 王红,余丽芸,侯喜林,等.牛呼吸道合胞体病毒重组N蛋白间接ELISA方法的建立及应用[J].中国农业科学,2010,43 (20):4303-4309. |
| 〔13〕 | Zhang JB,Lu XM,Wei HP,et al.Production and characterization of monoclonal antibodies to nucleoprotein of Marburg virus[J]. Hybridoma,2008,27(6):423-429. |
| 〔14〕 | James WG.Monoclonal antibodies:principles and practice[M].Academic Press,Inc Ltd,1983:142-147. |
 2012, Vol.28
2012, Vol.28



