2. 沈阳市大东区教育局中小学卫生保健所;
3. 中国医科大学
碘缺乏影响甲状腺素合成,导致甲状腺功能减退。海马是与学习记忆有关的关键脑区,碘缺乏可损伤海马组织,导致脑发育障碍和学习记忆力减退。有研究表明,信号蛋白蛋白激酶c( protein kinase C,PKC) 信号途径在脑发育及甲减性脑损伤过程中具有重要的作用〔1, 2〕,c-fos、c-jun 也是与学习记忆密切相关的即早基因。本研究分别用低碘饲料及他巴唑诱导,建立大鼠实验性低碘及甲状腺功能减退动物模型,对发育期大鼠海马组织c-fos、c-jun 表达进行观察分析,为碘缺乏、甲状腺功能减退导致脑发育障碍的发病机制研究提供依据。
1 材料与方法 1.1 材料健康雌、雄性2 月龄Wistar 大鼠45 只( 中国医科大学实验动物中心,动物合格证号SCXK-( 辽) 2003-2009) 。低碘饲料: 碘含量( 14.11 ± 1.958) ng /g,他巴唑5mg / 片( 上海中西药业股份有限公司新冈制药厂) 。标准饲料: 碘含量( 470.5 ± 46.52) ng /g 。
1.2 方法 1.2.1 动物选择及分组大鼠45 只,雌性30 只,雄性15 只。适应性喂养1 周后( 条件: 照明周期12 h,室温21 ~ 26 ℃) ,按体重将雌鼠随机分成3 组: 碘缺乏组( 低碘组) 、甲状腺功能减退组( 甲减组) 及对照组,每组10 只。
1.2.2 动物模型将雌、雄鼠以2∶ 1 合笼,以次日晨发现阴栓或阴道分泌物镜检发现精子者确定为妊娠0 d,记为E0。 低碘组于合笼前1 周开始喂饲低碘饲料,饮去离子水,至仔鼠生后30d。甲减组雌鼠喂饲标准饲料,自E10天给予含他巴唑饮水〔3〕,剂量为25 mg /dL,至仔鼠生后30 d。对照组喂饲标准饲料,饮自来水
。 1.2.3 血清甲状腺素测定收集生后30 d 仔鼠血清,按免疫放射试剂盒( 天津德普生物技术和医学产品有限公司) 说明书步骤,用γ-放射免疫计数器( 西安核仪器厂: FJ-2008PS) 测定FT3、FT4。
1.2.4 蛋白激酶C ( protein kinase C,PKC) 活性测定将仔鼠在其生后第30 d 时取脑,于冰盘上剥离出2 侧海马,封存于液氮罐中备用。分离细胞浆PKC 取1 /2 海马称重,加粉碎液( 2 mmol /L 乙二胺四乙酸( EDTA) ,10mmol /L 乙二醇乙醚 ( EGTA) ,20 mmol /L Tris-HCL pH7.5,250 mmol /L Sucros) 至 50 mg /mL。超声粉碎20s,间隔20 s,3 次。4 ℃,12 000 r /min 离心1 h,将上清沉淀分开待用。分离细胞膜PKC 用0.5 mL 1%Triton-X100( 含5 mmol /L EGTA,5 mmol /L EDTA) 将沉淀悬起,超声粉碎,4 ℃,12000 r /min 离心1 h,取上清待用。 PKC 活性测定用改良Takai 方法。反应总体积为0.25 mL( 含有20mmol /L Tris-HCL pH7.5,5mmol /L 醋酸镁,30 mmol /L 2-巯基乙醇,0.5 μC [γ32P]腺嘌呤核苷三磷酸 ( adenosine-triphosphate,ATP) ,海马长时程增强( long-term potentiation,LTP) ,约3 × 105 cpm,100μg 鱼精蛋白硫酸盐为底物) 。反应以加入同位素开始,30 ℃ 水浴中反应3min,以 10%三氯醋酸3mL 终止反应,将反应产物抽滤至滤膜上 ( φ 0.45 μm) ,放入含5 mL 蒸馏水的液闪杯中,Beckman 闪烁计数仪测定其放射活性。
1.2.5 海马组织光镜标本制备与免疫组化测定分别取生后30 d 各组仔鼠,用1%戊巴比妥钠腹腔麻醉,左心室插管固定,先用温生理盐水50 ~ 100 mL 灌流,待流出液清亮后,用 4%多聚甲醛200 ~ 400 mL 持续灌流。取仔鼠大脑于4% 多聚甲醛中固定36 ~ 48 h,常规石蜡包埋,行冠状位连续切片,免疫组织化学SP( 即链霉菌亲和素-过氧化物酶法,streptavidin- perosidase SP) 染色法,石蜡切片常规脱蜡至水,滴加兔抗大鼠Ⅰ抗( 美国Santa Cruz 公司) 购自武汉博士德公司,室温孵育90min,滴加羊抗兔Ⅱ抗( 福州迈新生物技术开发有限公司) ,室温孵育10min,二氨基联苯胺( DAB) ( 3,3'-diaminobenzidine) 显色,蒸馏水终止反应,常规脱水、透明、封片。
1.2.6 免疫组化染色定量分析参照Paxions〔4〕大鼠脑图谱,用MetaMorph /DP10 /BX41 图象分析系统( UIC/OLYMPUS,US /JP) 定量分析400 × 镜下30 d 各组双侧背海马CA1 区c-fos、c-jun 免疫反应产物。每组选取10 个观察视野,每个视野选择30 个以上阳性细胞,阳性产物强度应用平均灰度值表示。灰度值越大,则阳性反应物的染色强度愈小,反之则染色强度越大。
1.3 统计分析采用SPSS 10.0 软件对数据进行统计分析,大鼠体重、血清FT3 ( 游离三碘甲状腺原氨酸) 、FT4 ( 游离甲状腺素) 、PKC 活性及c-fos、c-jun 灰度值各组间差异比较采用单因素χ2 分析,两两比较用q 检验,P<0.05 为差异有统计学意义。
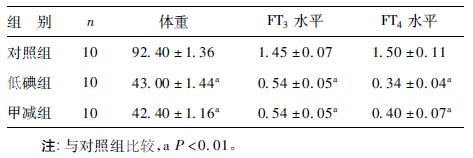
2 结果 2.1 仔鼠生长发育观察和血清甲状腺激素水平测定( 表 1)| 表 1 3 组仔鼠生后30d 时体重和FT3、FT4浓度水平 |
对照组仔鼠体重增加较快,活动性强,毛发发育正常; 低碘组和甲减组母鼠受孕率低,死产流产率高,仔鼠体重增加慢,体形小,尾短,行动迟缓,反应迟钝,开眼晚,毛发萌出晚且稀疏。由表 1 可见,生后30 d 低碘组和甲减组仔鼠体重及血清甲状腺激素FT3、FT4 浓度水平明显低于对照组,差异有统计学意义(P<0.01) 。
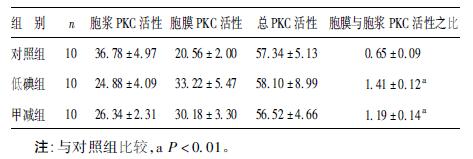
2.2 PKC 活性测定结果( 表 2)| 表 2 3 组仔鼠30 d 海马组织PKC 活性( pmol /min/mg) |
低碘组和甲减组仔鼠海马组织胞浆PKC 活性分别为( 24.8763 ± 13.7319 ) 和( 26.3420 ± 7.3028) pmol /min /mg,略低于对照组( 36.7758 ± 15.7113) pmol /min /mg,而胞膜PKC 活性( 33.2207 ± 18.3414 ) 、 ( 30.1775 ± 10.4433 ) pmol /min /mg,则稍高于对照组 ( 20.5598 ± 6.3121) pmol /min /mg,但差异无统计学意义(P>0.05) 。低碘组和甲减组仔鼠海马胞膜与胞液PKC 活性比值分别为( 1.4143 ± 0.3940) 和( 1.1871 ± 0.4325) ,较同日龄对照组( 0.6493 ± 0.2943) 有明显升高,差异有统计学意义(P<0.01) ,表明在低碘组和甲减组存在PKC 由胞浆向胞膜的转运过程。
2.3 仔鼠海马组织的免疫组化染色切片观察由仔鼠海马组织的免疫组化染色切片观察结果可见,生后30 d 对照组仔鼠免疫反应阳性产物分布在海马组织锥体细胞层、颗粒细胞层及多型细胞层等处,主要沉积在细胞核,少数沉积在细胞浆和细胞膜,多表现为棕黄色或棕褐色点状、颗粒状。低碘组、 甲减组与对照组比较,染色强度弱,染色阳性细胞数减少。与对照组相比,免疫反应产物分布在细胞核中的减少,分布在细胞浆和细胞膜中的相对增多。
2.4 c-fos、c-jun 免疫组化定量结果( 表 3)| 表 3 3 组仔鼠生后30 d 海马组织c-fos、c-jun 灰度值比较 |
生后30 d 低碘组和甲减组仔鼠海马组织c-fos、c-jun 灰度值均明显高于对照组(P<0.01) 。提示碘缺乏、甲状腺功能减退可降低仔鼠海马组织即早基因c-fos、c-jun 表达。
3 讨论甲状腺激素对哺乳动物中枢神经系统的发育有重要作用。碘缺乏影响甲状腺素合成,导致甲状腺功能减退,进而影响学习记忆功能。其主要原因是碘缺乏、甲状腺功能减退对海马结构和功能的影响。蛋白激酶PKC 是一类Ca2+、磷脂依赖性的蛋白激酶系统,与神经生长因子的作用有关,在跨膜信号传递过程中起重要作用〔1, 5〕。PKC 向膜的转运可使神经细胞发生损伤〔6〕,导致脑功能紊乱〔7, 8〕。即刻早期基因 ( IEGS) 与学习记忆调控密切相关〔9, 10〕,c-fos、c-jun 蛋白的合成在学习记忆特别是长时记忆形成的过程中起重要作用〔10, 11〕,神经元可塑性被认为在记忆过程中起关键作用〔12, 13〕,一定剂量的碘可明显促进体外培养海马神经元 c-fos、c-jun 的表达〔14〕。
本研究结果表明,碘缺乏、甲状腺功能减退可以降低血清游离甲状腺激素水平,低水平的甲状腺素可引起仔鼠海马细胞胞浆PKC 向膜的转位,并使脑发育关键期海马组织即早基因c-fos、c-jun 表达下降,免疫反应产物主要分布在细胞浆和细胞膜,细胞核中表达程度明显低于正常对照组。故认为 PKC 由胞浆向胞膜的转运,c-fos、c-jun 表达程度及分布的变化,可影响海马学习记忆特别是长时记忆的形成,在低碘及甲减性脑损害的形成中具有一定作用。
| 〔1〕 | Battaini F,Pascale A,Paoletti R,et al.The role of anchoring protein RACK1 in PKC actibation in the aging rat brain[J].Trends Neurosci,1997,20:410-415. |
| 〔2〕 | 苏青,罗敏,陈源.甲状腺激素缺乏对发育期鼠脑蛋白激酶 C活性的影响[J].中华内分泌代谢杂志,2000,16:106-108. |
| 〔3〕 | Heurteaux C,Messier C,Destrade C,et al.Memory processing and apamin induce immediate early gene expression in mouse brain[J].Brain Res Mol Brain Res,1993,18:17-22. |
| 〔4〕 | Paxions G,Watson C.The rat brain in sterotaxic coordinates[M].Sydney Academic Press,1982. |
| 〔5〕 | 蔡东升.甲状腺激素与脑信号传导系统[J].国外医学:内分泌学分册,2001,21(2):73-76. |
| 〔6〕 | 孙黎光,朱延松,侯伟健,等.铅对大鼠海马神经元胞质PKC活性的影响[J].中国医科大学学报,2002,31(5):326-328. |
| 〔7〕 | Leung L,Saggerson D,Clak JB.Signal transduction processes in the developing brain:perturbations of G protein alpha-subunit abundances by perinatal hyroidism[J].Dev Neurosei,1996,18:153-161. |
| 〔8〕 | Igarashi M,strittmatte SM,Vatranian T,et al.Mediation by G protein of signals that cause collapse of growth cones[J].Science,1993,259:77-79. |
| 〔9〕 | Rose SP.How chicks make memories:the cellular cascade from c-fos to dendritic remodeling[J].Trends Neurosci,1991,14:390-397. |
| 〔10〕 | Grant SG,O’Dell TJ,Karl KA,et al.Impaired long-term potentiation,spatial learning,and hippocampal development in fyn mutant mice[J].Science,1992,258:1903-1910. |
| 〔11〕 | Wisden W,Errington ML,Williams S,et al.Differential expression of immediate early genes in the hippocampus and spinal cord[J].Neuron,1990,4:603-614. |
| 〔12〕 | Nikolaev E,Tischmeyer W,Krug M,et al.C-fos protooncogene ex-pression in rat hippocampus and entorhinal cortex following titanic stimulation of the perforant path[J].Brain Res,1991,560:346-349. |
| 〔13〕 | Dragunow M,Abraham WC,Goulding M,et al.Long-term potentiation and the induction of c-fos mRNA and proteins in the dentate gyrus of unanesthetized rats[J].Neurosci Lett,1989,101:274-280. |
| 〔14〕 | 田东萍,苏敏,吴贤英,等.硒、碘对大鼠海马神经细胞原癌基因c-fos、c-jun表达的影响[J].中华病理学杂志,2002,31(3):245-249. |
 2011, Vol. 27
2011, Vol. 27