自然流产是妇产科常见病,育龄期妇女的发生率约为1%~2%,其中有50%原因不明〔1〕。促胃泌素释放肽(gastrin-releasing peptide,GRP)是一种与两栖类蛙皮素相似的物质,主要分布在哺乳动物胃肠系统、大脑、脑垂体、脊髓、交感神经节、泌尿生殖系统等组织〔2〕。在人类妊娠阶段,GRP主要在胚胎绒毛滋养层、滋养层外绒毛和羊膜上皮细胞表达〔3〕。GRP与人类的正常妊娠有关,本研究采用小鼠自然流产模型,通过免疫组化法和免疫印迹(western blot)检测母胎界面GRP的表达情况,分析GRP与自然流产的关系。
1 材料与方法 1.1 仪器与试剂IQ300凝胶成像仪(通用电气医疗系统有限公司),电泳仪(瑞典法玛西亚公司),半干转印系统(上海伯乐生命医学产品有限公司),JGD-900L超声波细胞粉碎机(上海之信仪器有限公司)。促胃泌素释放肽抗体(荷兰ED公司),免疫组化试剂盒(福州迈新生物技术有限公司)。
1.2 动物模型制备采用雌性CBA/J小鼠、雄性DBA/2和BALB/C小鼠(上海斯莱克实验动物有限公司),8~10周龄。恒定温度和湿度、每天光照12 h笼养2周后,将雌性CBA/J小鼠分别与雄性DBA/2和BALB/C小鼠以2:1合笼交配,以检测到阴栓日记为妊娠第1 d。将与雄性DBA/2交配后的雌性CBA/J小鼠作为自然流产模型组(10只);与雄性BALB/C交配后的雌性CBA/J小鼠作为正常对照组(10只)。
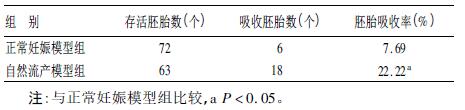
1.3 胚胎吸收率于孕14 d将各组CBA/J小鼠处死,打开腹腔分离子宫。用生理盐水洗净后置于干净滤纸上,计数总的胚胎数、存活胚胎数(Re)和吸收胚胎数(F),通过R=Re/(Re+F)的公式计算胚胎吸收率(R),评价模型建立的成功与否。其中肉眼可见鲜红、完整的胚胎为存活胚胎;肉眼见苍白、不完整的胚胎为吸收胚胎。
1.4 免疫组织化学染色10%福尔马林固定,石蜡包埋,4~5 μm连续切片。标本经脱蜡、水化后,经3% H2O2孵育10 min消除内源性过氧化物酶活性,微波抗原修复10 min后滴加5%牛血清白蛋白封闭血清20 min,加1:50稀释一抗(促胃泌素释放肽抗体)4℃过夜。经生物素标记的二抗室温孵育45 min后二氨基联苯胺(DBA)显色、苏木素复染、透明封片、显微镜下观察。胞浆为棕黄色染色者为阳性细胞。用磷酸盐缓冲液代替一抗作为阴性对照;以已知的GRP标本作为阳性对照。
1.5 Western blot方法取少量组织(1~2 g)研磨成匀浆后转入微量离心管中,超声粉碎,吸取上清液,并加热使蛋白变性。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转膜,经5%脱脂奶粉封闭后依次加入GRP抗体和辣根过氧化酶标的二抗。经二氨基联苯胺(DAB)显色后用凝胶成像仪分析实验结果。
1.6 统计分析采用SPSS 13.0统计软件进行χ2检验和t检验,以P<0.05为差异有统计学意义。
2 结 果 2.1 胚胎吸收率比较(表 1)| 表 1 各组胚胎吸收率比较(n = 10) |
自然流产模型组的胚胎吸收率22.22%,对照组的胚胎吸收率7.69%,自然流产模型组的吸收率明显高于对照组,差异有统计学意义(χ2=6.545 7,P=0.010 5)。表明自然流产模型建立成功。
2.2 母胎界面GRP免疫组化染色免疫组化染色所有切片染色背景清晰,阴性对照不着色。GRP阳性染色镜下显示组织细胞结构清晰,细胞质中出现棕黄色或褐色颗粒,染色明显高于背景。正常妊娠组的母胎界面蜕膜组织中GRP表达的灰度值为(163.23 ± 5.1),自然流产组母胎界面蜕膜组织中GRP表达的灰度值为(145.48 ± 4.7),差异有统计学意义(t=8.093 3,P=0.000)。
2.3 Western-blot实验结果(图 1)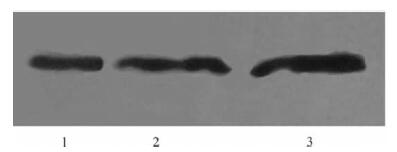 |
注:1: GRP 蛋白阳性对照( 91Kb) ; 2: 自然流产组GRP 条带; 3: 正常妊娠组GRP 条带. 。图 1 GRP 蛋白的western blot 结果 |
经western blot检测,出现清晰条带,为GRP阳性。自然流产模型组GRP阳性率为30.0%,正常妊娠组为90.0%,差异有统计学意义(P=0.020)。
3 讨 论GRP是近年发现的一种内分泌肽类〔4〕,以前认为GRP主要是一种神经传递素,可刺激胃泌素分泌和调节多种胃肠激素释放〔5〕。近来研究表明,在雌性生殖系统中,GRP可由妊娠期的宫颈腺上皮和胎盘细胞分泌,行使多种生理功能,如控制子宫内膜的上皮离子通道,调节子宫收缩,影响子宫内膜增生和分化,抑制宫内感染发生〔6〕。同时GRP作为子宫内膜调节肽和有丝分裂原,在胚胎和子宫发育中起调节作用〔7〕。
本研究显示,在正常妊娠过程中,GRP在母胎界面高表达,GRP可通过调节胚胎和子宫内膜的生长来促进妊娠的正常进行。Whitley〔4〕等研究表明,GRP在妊娠全过程持续表达,参与黄体功能的维持。而在自然流产模型中GRP的表达较低。有研究表明,正常情况下GRP参与妊娠过程中子宫内膜细胞的分化、胚泡的生长和发育、孕体的形成、胚胎的植入及胎盘和胚胎的发育〔4, 7〕。GRP的低表达可导致子宫内膜发育不良,胚泡生长不佳,胚胎异常植入从而导致自然流产的发生。
| 〔1〕 | Rai R,Regan L.Recurrent miscarriage[J].Lancet,2006,368(9535):601-611. |
| 〔2〕 | Budipitojo T,Sasaki M,Matsuzaki S,et al.Localization and expression of gastrin-releasing peptide(GRP)in the bovine cervix[J].J Reprod Dev,2004,50(1):119-129. |
| 〔3〕 | Fleischmann A,Waser B,Gebbers JO,et al.Gastrin-releasing peptide receptors in normal and neoplastic human uterus:involvement of multiple tissue compartments[J].J Clin Endocrinol Metab,2005,90(8):4722-4729. |
| 〔4〕 | Whitley JC,Moore C,Giraud AS,et al.Isolation and characterisation of the ovine gastrin-releasing peptide gene:abundant expression in the pregnant uterus and selective expression in fetal tissues[J].J Endocrinol,2002,175(2):447-457. |
| 〔5〕 | Ischia J,Patel O,Shulkes A,et al.Gastrin-releasing peptide:different forms,different functions[J].Biofactors,2009,35(1):69-75. |
| 〔6〕 | Kimura J,Budipitojo T,Sasaki M,et al.Immunolocalization of gastrin-releasing peptide(GRP)in the uteroplacenta of the mouse deer[J].Anat Histol Embryol,2006,35(4):217-220. |
| 〔7〕 | Song G,Satterfield MC,Kim J,et al.Gastrin-releasing peptide(GRP)in the ovine uterus:regulation by interferon tau and progesterone[J].Biol Reprod,2008,79(2):376-386. |
 2011, Vol. 27
2011, Vol. 27