2. 中国疾病预防控制中心职业卫生与中毒控制所;
3. 乐亭县疾病预防控制中心;
4. 唐山市工人医院
石英粉尘是中国最主要的职业危害因素之一,可致矽肺,也可致癌。以往研究表明,DNA可以通过氢键与石英表面的SiO·自由基结合,形成DNA-石英复合物进而影响DNA复制、修复和基因表达,并干扰纺锤体的形成和染色体的分离,最终导致基因突变以及肿瘤形成〔1, 2, 3〕。近期研究表明,石英可引起DNA的损伤〔4, 5〕。DNA双链断裂(DNA double strand breaks,DSBs)是DNA损伤中最严重的一种。本研究拟联合应用rH2AX磷酸化(rH2AX)免疫荧光技术、中性彗星实验以及微核实验观察石英致DNA及染色体损伤的作用,从细胞分子水平上探讨矽肺的致病机制。
1 材料与方法 1.1 仪器设备CO2孵箱(加拿大Ravco公司)、6孔培养板(美国Corning Costar公司)、电泳仪(美国Bio Rad公司)、Cytospn 4涂片机(美国Thermo Scientific公司)、NIKON E400荧光显微镜。
1.2 细胞及主要试剂人胚肺成纤维细胞(human embryo lung fibroblast,HELF)(中国医学科学院基础所细胞室)。标准的α石英粉尘(中国疾病预防控制中心职业卫生与中毒控制所),经玛瑙研钵研磨后尘粒直径≤5μm的>95%。H2AXSer139磷酸化抗体(美国Upstate Biotechnology公司)、辣根过氧化物酶标记的山羊抗鼠二抗(北京中杉金桥生物公司)。
1.3 免疫荧光实验参照文献〔6〕,相应调整加入抗体。选择合适的滤光片进行观察,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记:495nm,Image-ProPlus 6.0软件进行半定量分析。
1.4 彗星实验按实验设计处理细胞,1000g离心收集细胞,调浓度至1×106/L。中性单细胞凝胶电泳试验参照文献〔7〕。胶片经溴化乙锭(ethidium bromide,EB)染色后荧光显微镜下观察并拍摄照片,结果判定,首先由目测初步判定,然后使用国产单细胞凝胶电泳分析软件IMI1.0〔8〕,以Olive矩来表示DSBs损伤程度。
1.5 微核实验按实验设计处理细胞,同时设双氧水阳性对照组(50μmol/L)(预试验表明对照组的作用浓度对细胞活力没有显著影响)。去除培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)清冼。加入新鲜的含10%小牛血清的培养基,加入松胞素B(终浓度为3μg/mL)继续培养1.5个细胞周期(HELF:32h)。作用结束,PBS清冼,消化,涂片机甩片(300g,1min),干燥10min,固定10min。将玻片置于室温下自然干燥过夜。10%吉姆萨氏染液染色10min,于10×100倍光镜下,计数1000个双核细胞中的微核细胞数。
1.6 统计分析采用SPSS 14.0统计软件对数据进行方差分析和t检验,以P<0.05为差异有统计学意义。
2 结 果 2.1 免疫荧光实验(图 1) | 注:不同剂量的石英刺激HELF 细胞12 h,γH2AX 焦点形成情况,图中绿色( FITC 标记) 标记γH2AX,比例尺: 100 μm。图 1 不同剂量石英诱导的γH2AX 焦点形成情况 |
阴性对照组不加一抗,直接滴加二抗,呈阴性反应,灰度值为33.3±17.1)。说明实验系统无明显误差,为特异性染色。100μg/mL石英刺激HELF细胞12h,γH2AX磷酸化焦点水平增高,与无石英刺激组比较,差异有统计学意义。随着石英剂量增加到200、400μg/mL,γH2AX磷酸化焦点水平增高更加明显,提示石英与DNA双链断裂存在剂量效应关系。
2.2 中性彗星实验(表 1,图 2)
表 1 不同剂量石英刺激HELF 细胞DSBs损伤程度及微核率(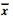 ±s) ±s) |
 | 注:比例尺: 100 μm。图 2 不同剂量石英刺激HELF 细胞12h 中性彗星电泳图 |
将Olive矩作为DSBs损伤程度的指标,结果显示石英刺激可引起DSBs损伤程度增高,且与石英存在剂量效应关系。
2.3 微核实验(表 1)双氧水阳性对照组的微核细胞率为16‰,明显高于空白对照组。不同剂量石英刺激后,微核细胞率均稍有增加,但与空白对照组比较,差异均无统计学意义。
3 讨 论粉尘中的游离SiO2(石英为代表)含量越高,致肺组织纤维化的能力越强。陈朝东等〔9〕的研究发现,宝石加工厂的游离SiO2含量平均为92.79%,工人矽肺发病率高,工龄短,肺功能损害严重。1997年国际癌症研究组织(International Agency for Research on Cancer,IARC)宣布将石英升级为人类致癌物〔10〕。细胞无度增殖是癌症的基本特征,成纤维细胞的大量增殖则是纤维化的必然现象,细胞的异常增值与基因组的不稳定性有关。
Rogakou等于1998年首先发现电离辐射处理后,H2AX的SQE结构域中的139位点Ser残基迅速被磷酸化,并且在DSBs处形成焦点〔11〕。本研究中,免疫荧光法与彗星实验的结果一致,均表明石英可引起DSBs,且100μg/mL剂量组H2AX的水平增高且差异有统计学意义,说明rH2AX免疫荧光法的灵敏度高于传统的彗星实验。
H2AX可作为遗传毒性检测的标志物,对博来霉素等遗传毒物刺激产生阳性反应,呈剂量-反应关系,与彗星实验、微核实验结果一致〔12〕。微核实验的遗传学终点是观察染色体或有丝分裂器的损伤,DSBs修复不完全将会导致基因组不稳定性增加。但在相同实验条件下,微核率的变化与免疫荧光法及彗星实验结果并不一致,对此尚需进一步的研究。
损伤的DNA未被修复或修复不正确,将导致基因突变或染色体畸变,细胞死亡/凋亡,或发展为癌细胞〔13〕。对石英致DNA损伤机制的研究可为尘肺病的早期筛查、诊断及治疗提供理论依据。
| 〔1〕 | Zhang Z,Shen HM,Zhang QF,et al.Involvement of oxidative stress in crystalline silica-induced cytotoxicity and genotoxicity in rat alveolar macrophages[J].Environ Res,2000,82(3):245-252. |
| 〔2〕 | Ding M,Chen F,Shi X,et al.Diseases caused by silica:mechanisms of injury and disease development[J].Int Immunopharmacol,2002,2(2):173-182. |
| 〔3〕 | Basaran N,Shubair M,Undeger U,et al.Monitoring of DNA damage in foundry and pottery workers exposed to silica by the alkaline comet assay[J].Am J Ind Med,2003,43(6):602-610. |
| 〔4〕 | Fanizza C,Ursini CL,Paba E,et al.Cytotoxicity and DNA-damage in human lung epithelial cells exposed to respirable alpha-quartz[J].Toxicol In Vitro,2007,21(4):586-594. |
| 〔5〕 | 张凤梅,刘秉慈,刘海峰,等.DNA-PKcs在石英诱导的DNA双链断裂修复中的作用[J].中华劳动卫生职业病杂志,2009,27(1):2-6. |
| 〔6〕 | Jia X,Liu B,Ye M,et al.Silica induces cell cycle changes through PI-3K/AP-1 pathway in human embryo lung fibroblast cells[J].Cell Biochem Funct,28(7):613-619. |
| 〔7〕 | Smart DJ,Halicka HD,Schmuck G,et al.Assessment of DNA double-strand breaks and gamma H2AX induced by the topoisomerase II poisons etoposide and mitoxantrone[J].Mutat Res,2008,641(1-2):43-47. |
| 〔8〕 | 朱志良,庄志雄,黄钰.单细胞凝胶电泳图像分析系统的研制与应用[J].中华劳动卫生职业病杂志,2001,19:298-300. |
| 〔9〕 | 陈朝东,张东辉,丘创逸,等.宝石工矽肺发病现况调查[J].中国公共卫生,2005,21(3):317-318. |
| 〔10〕 | Adverse effects of crystalline silica exposure.American Thoracic Society Committee of the Scientific Assembly on Environmental and Occupational Health[J].Am J Respir Crit Care Med,1997,155:8. |
| 〔11〕 | Rogakou EP,Pilch DR,Orr AH,et al.DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139[J].J Biol Chem,1998,273(10):5858-5868. |
| 〔12〕 | Watters GP,Smart DJ,Harvey JS,et al.H2AX phosphorylation as a genotoxicity endpoint[J].Mutat Res,2009,679(1-2):50-58. |
| 〔13〕 | Hefferin ML,Tomkinson AE.Mechanism of DNA double-strand break repair by non-homologous end joining[J].DNA Repair(Amst),2005,4(6):639-648. |
 2011, Vol. 27
2011, Vol. 27



