欧猥迭宫绦虫(Spirometra erinaceieuropaei,S.e)又名曼氏迭宫绦虫(Spirometra mansoni,S.m),是我国及东亚、东南亚国家及地区较为常见的人兽共患寄生虫,其幼虫裂头蚴(plerocercoid)可寄生人体引起裂头蚴病(plerocercoidosis),成虫偶可寄生人体〔1〕。由于成虫寄生于宿主小肠无氧环境,其能量主要依赖于无氧糖酵解,乳酸脱氢酶(lactatedehydrogenase,LDH)是糖酵解途径的末端酶,在寄生虫能量代谢中起着重要作用。
本研究在构建S.e成虫全长cDNA文库、大规模5’端表达序列标签(expressed sequence tag,EST)测序的基础上,发现编号GDTC009-C10克隆的797bpEST序列与华支睾吸虫LDH(CsLDH)同源性最高为60%,随即延长测序,经拼接后获得一全长cDNA序列用生物信息学方法对该序列进行识别、鉴定,并对其编码蛋白结构和功能进行预测,以期为其功能研究提供科学依据。
1 材料与方法 1.1 材 料欧猥迭宫绦虫成虫全长cDNA质粒文库构建、大规模EST测序、Blastn、Blastx、unigene归并由本课题组与上海联合基因公司合作完成。目标基因的质粒编号为GDTC009-C10。其他寄生虫(日本血吸虫、华支睾吸虫、恶性疟原虫)及模式生物(秀丽杆线虫、果蝇、斑马鱼、非洲爪蛙、原鸡、家鼠及人)LDH氨基酸序列源自GenBank(序列号略)。
1.2 实验方法参照文献〔2〕方法进行。
2 结 果 2.1 基因的识别、鉴定(图 1) | 图 1 推测SeLDH 氨基酸序列 |
所获cDNA序列由1233个核苷酸组成,最大编码序列为1016bp,编码338氨基酸残基(aa),polyA位于1178~1195bp,推测的氨基酸序列见图 1,结构域及功能域预测该序列具有典型的L-LDH结构域、完整的L-LDH-NAD保守功能域及L-LDH功能基序IGEHGDS(196~202aa),由此证明克隆GDTC009_C10的插入序列为LDH全长cDNA,命名为SeLDH,GenBank登录号为GU121968。
2.2 同源基因多序列比对、同源性及分子进化分析多序列同源比对,所有物种具有多个共同保守位点,SeLDH关键酶催化位点高度保守,分别位于112(R)、172(D)及(199H)。SeLDH与同为扁平动物门的CsLDH、SjLDH同源性最高,分别为60%和59%,与PfLDH同源性最低为26%;与其他物种的同源性在53%~56%,例如与HsLDH的同源性为55%。分子进化分析显示SeLDH与同门的SjLDH及CsLDH源于同一祖先,其进化地位较原虫高,与线虫、果蝇的进化关系较近,与脊椎动物进化关系最远。
2.3 理化参数、信号肽、亚细胞定位预测SeLDH预测等电点(PI)为6.38,分子量为36028.6Da,280nm水溶液中的消光系数为35450单位/M/cm,在哺乳动物、酵母及大肠埃希菌中的半衰期分别为30、>20、>10h小时,不稳定系数为24.62,属于稳定蛋白。发现疑似信号肽序列,酶切位点位于18aa-19aa处,无线粒体、核、过氧化物酶体等的靶向信号,预测为细胞质内蛋白的可信度为94.1%,定位于内质网、线粒体、核的可能性分别为55.6%、33.3%、11.1%。
2.4 亲水性及B细胞线性表位预测亲水性和B细胞线性表位预测结果基本相同,可能的抗原表位位于104~111aa、185~191aa、198~202aa、222~235aa、328~338aa,其中185~191aa、222~235aa、328~338aa与HsLDH以及SjLDH、CsLDH相同区域差异显著,可能是较为理想的特异性诊断抗原表位。
2.5 蛋白质拓扑结构分析、NAD及底物结合位点、翻译后修饰位点预测(图 2) | 注: 粗体字- 关键催化位点; 双下划线- 抗原表位; T - 跨膜区; i - 膜内; o - 膜外; # - NAD 结合位点; * - 丙酮酸结合位点。图 2 SeLDH 氨基酸序列的拓扑分析 |
SeLDH拓扑结构预测结果如图 2所示。该蛋白具有五个可能的跨膜区域,推测可能是膜蛋白,N端在膜内,C端在膜外。预测共有14个NAD结合位点及6个底物丙酮酸结合位点,NAD及底物结合位点主要集中在三个关键催化位点112(R)、172(D)及199(H)周围。该蛋白有1个N-糖基化位点,4个蛋白激酶C磷酸化位点,3个酪蛋白激酶II磷酸化位点,6个N-豆蔻酰化位点,1个原核细胞膜脂蛋白脂质附着位点,1个L-乳酸脱氢酶活性位点。
2.6 三级结构同源建模及分析(图 3)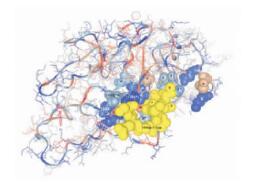 | 注:显示104aa - 111aa 区域、关键催化位点、NAD( #) 及丙酮酸( * ) 结合位点图 3 SeLDH 三级结构模型 |
目前GenBank中尚无假叶目绦虫LDH全长cDNA序列的记录,本研究从S.e.成虫cDNA全长文库中筛得SeLDH全长cDNA,对SeLDH的识别及对其结构与功能的预测,为研究其与圆叶目绦虫及其他寄生虫LDH差异,指导后期功能研究及应用研究奠定了基础。
SeLDH预测等电点(PI)为6.38,分子量为36028.6Da,对SeLDH的信号肽、跨膜结构及拓扑结构分析结果显示该蛋白具有信号肽及5个可能的跨膜区域,具有膜蛋白的特性,推测其可能是跨膜蛋白或膜相关蛋白。
对SeLDH亲水性分析及B细胞线性表位分析结果表明,该序列具有5个可能的抗原表位,其中表位185aa~191aa、222aa~235aa、328aa~338aa与宿主HsLDH及同门的SjLDH、CsLDH相同区域差异较大,可能是理想的特异性诊断抗原表位。表位104aa~111aa尽管与宿主LDH相同区域相似性较高(87.50%),但该表位恰是NAD及底物丙酮酸结合区之一;构建的三级结构模型显示该表位位于蛋白表面,关键催化位点112R与172D及199H构成的催化中心紧邻该表位,部分NAD及底物丙酮酸结合位点位于该区域上,其他结合位点均集中于该区域周围,提示相应抗体与其结合不仅能介导免疫攻击,而且还有酶特异性抑制剂作用,阻止底物丙酮酸的结合,使丙酮酸在细胞内积聚致使虫体死亡,可视为高特异性的药物分子;针对该位点的化合物如NAD及丙酮酸类似物也可起到阻断酶活性的作用,从而达到杀虫的目的,因此该表位是理想的疫苗、药物作用位点,可用于抗虫新药的筛选。对疟原虫、弓形虫的新药研究也主要集中于该区域〔3,4,5〕。另外,吡喹酮(praziquantel,PZQ)作为一种重要的抗寄生虫药物,对扁形动物门的吸虫、绦虫均有良好的杀虫效果,但其分子作用机制目前尚未完全明了,作者等在对SjLDH研究时发现PZQ对重组SjLDH的活性有显著抑制作用,提示LDH可能是PZQ的分子作用靶标之一〔6〕,是否作用于该区域,值得进一步研究。
| 〔1〕 | 裘明华,裘明德.人裂头蚴病和无头蚴病:I.病原学的过去和现在[J].中国寄生虫学与寄生虫病杂志,2009,27(1):54-60. |
| 〔2〕 | 吕刚,余新炳,黄灿,等.日本血吸虫乳酸脱氢酶(SjLDH)结构与功能的生物信息学分析[J].中国寄生虫学与寄生虫病杂志,2007,25(3):161-165. |
| 〔3〕 | Brown WM,Yowell CA,Hoard A,et al.Comparative structural analysis and kinetic properties of lactate dehydrogenases from the four species of human malarial parasites[J].Bioch,2004,43:6219-6229. |
| 〔4〕 | Dando C,Schroeder ER,Hunsaker LA,et al.The kinetic properties and sensitivities to inhibitors of lactate dehydrogenases(LDH1 and LDH2)from Toxoplasma gondii:comparisons with pLDH from Plasmodium falciparum[J].Mol Biochem Parasitol,2001,118(1):23-32. |
| 〔5〕 | Cameron A,Read J,Tranter R,et al.Identification and activity of a series of azole-based compounds with lactate dehydrogenase directed anti-malarial activity[J].J Biol Chem,2004,279(30):31429-31439. |
| 〔6〕 | 吕刚,胡旭初,黄灿,等.棉子酚、吡喹酮及蒿甲醚对重组日本血吸虫乳酸脱氢酶作用的研究[J].中国寄生虫学与寄生虫病杂志,2007,25(5):401-405. |
 2011, Vol. 27
2011, Vol. 27
