2. 延边大学医学部药学院
肥大细胞膜表面表达IgE 高亲和力受体,经活化后可产 生和释放多种参与变态反应的炎性介质,这些介质影响内皮 细胞、上皮细胞、平滑肌细胞等,从而引起多种变态反应症 状[1]。黑米为优良的特种稻米,黑米中特别是谷皮层中,含 有丰富的花青素物质。研究报道黑米花色苷具有抗氧化、保 护心血管、预防动脉粥样硬化等作用[2, 3]。本研究以动物腹 腔肥大细胞为主要实验对象,探讨黑米花色苷提取物对肥大 细胞的影响,并探讨其作用的信号转导机制。
1 材料与方法 1.1 实验动物体重为200~ 250 g 的健康成熟S D雄性大 鼠60只(延边大学医学部动物室)。室温( 22 ± 1) ℃ 、相对湿 度50% ~ 60%、光照周期12 ~ 12 h环境中适应饲养1周后实 验。
1.2 材料采用如下制备技术路线: 黑米皮( 黑米外层约 10%,延边大学医学部药学院医药开发中心) → 60% 乙醇浸 提(含0. 1%HC1,浸提3 次,每次12 h) → 真空浓缩→ 脱脂 (石油醚) → Am be rlite XAD- 7大孔吸附树脂分离( 上海富众 仪器有限公司) → 80% 乙醇洗脱→ 真空浓缩→ 冷冻干燥。
1.3 试剂抗二硝基苯基化免疫球蛋白E ( Anti-DNP IgE) 单克隆抗体、二硝基苯基化人血清白蛋白( DNP-H SA )、四甲 基偶氮唑蓝(MTT) 、组胺检测试剂盒、C a2+ 同位素、氮卓斯 汀、抗β-ac tin抗体以及4-羟乙基哌嗪乙磺酸; N-( 2-羟乙基) 哌嗪-N-'2-乙烷磺酸 ( HEPES) (美国 S igma公司 ),肿瘤坏死因 子-α( TNF-α)、白介素-6( IL-6抗体) (美国Santa Cruz公司)。
1.4 腹腔肥大细胞的获取腹腔肥大细胞的分离提纯是采 用Cho i等[4]的方法。
1.5 被动皮肤过敏反应( PCA) 实验[4]将健康SD 大鼠随 机分为6组: 包括正常对照组,模型对照组,黑米花色苷提取 物低、中、高剂量组( 50、150、300 m g /kg) 及阳性药物对照组 (氮卓斯汀,10 m g /kg),每组10只大鼠。大鼠背部皮内注射 200 ng anti-DNP IgE,24 h 后大鼠阴部静脉注射含有100 µg DNP HAS的1%伊文思蓝混合液200 µL。注射伊文思蓝前 24、12、1 h 黑米花色苷提取物灌胃治疗。30 m in后,切开背部 皮肤蓝色斑点注射部位,称其重量,将其细切放入H EPES-Ty- rode溶液在60 ℃ 水浴箱上放置3 h。将渗出的伊文思蓝浓度 用分光光度计在620 nm 下测定密度,计算出伊文思蓝浓度。
1.6 细胞毒性实验[5]利用MTT 进行检测黑米花色苷提取 物的细胞毒性[5]。
1.7 肥大细胞组胺释放量测定[5]在肥大细胞悬液中加入 anti-DNP IgE ( 10 µ g /L)致敏,在37 ℃ 孵育6 h。分别加入黑 米花色苷提取物高、中、低剂量组( 100、50、25 µg /L)、阳性对 照( 氮卓斯汀,10 µg /L) ,洗净,然后各组分别加入DNP-HSA ( 100 ng /mL),孵育30 m in,离心后取适量细胞上清分别用于 测定组胺。
1.8 肥大细胞内钙摄入量测定[6]将分离提纯的肥大细胞 中,放入含有1 µC i45 Ca2+ /mL 的HERES-Tyrode 缓冲溶液 (MgC l2、CaC l2 除外),再悬浮。加入an ti-DNP IgE ( 10 µg /L) 致敏,在37 ℃ 孵育6 h,分别加入黑米花色苷提取物、阳性对 照氮卓斯汀,作用10 m in,洗净,各组分别加入DNP-HSA( 100 ng /mL),孵育30 m in。离心后除去上层液,用Tr iton - 100破 坏肥大细胞,计算出钙离子量。
1.9 蛋白免疫印迹w estern b lo t检测TNF-α、IL-6 [6]在腹 腔肥大细胞中加入anti-DNP IgE ( 10 µg /L) 致敏,在37 ℃ 培 养基孵育6 h,换洗后,加入黑米花色苷提取物作用10 m in,洗 净,各组分别加入DNP-H SA ( 100 ng /mL) ,孵育30 m in。离心 后除去上层液,加入裂解液,取上清液测蛋白浓度。取20 µg 蛋白电转移至聚偏二氟乙烯( PVDF) 膜上,加入TNF-α及IL- 6抗体,洗膜后显影及定影。
1.10 统计分析采用SPSS 11. 0软件进行单因素方差分析 ( Onew ay ANOVA) 检验。
2 结 果 2.1 黑米花色苷提取物对PCA影响(表 1 )与模型组比 较,黑米花色苷提取物各治疗组均能减少染料的渗出,其中 高、中( 300、150 m g /kg)剂量组与模型组比较,差异有统计学 意义( P < 0. 05)。
|
|
表 1 黑米花色苷提取物对被动皮肤过敏 反应的影响(x±s , n= 10) |
(表 2) MTT测定结果表明,黑米花色苷提取物10 ~ 200 µg /L浓度对肥大细胞活性几乎无影响。与模型组比较,黑米 花色苷提取物各治疗组均能抑制组胺的生成和钙摄入量,其 中高、中( 100、50 µg /L)剂量组与模型组比较,差异有统计学 意义( P < 0. 05)。
|
|
表 2 黑米花色苷提取物对肥大细胞生长及对组胺释放、钙摄入量的抑制作用(x±s , n= 10) |
电 泳条带吸光度分析显示,模型组TNF-α蛋白表达较对照组增 加8. 9倍,黑米花色苷提取物( 25、50、100 µg /L)给药10 m in 使TNF-α蛋白表达分别下降7. 8%、80%与85%。

|
注: 与正常组比较,aP < 0. 01; 与模型组比较,bP < 0. 01。 A: 蛋白免疫印迹; B: 光密度比较 图 1 不同组肥大细胞的肿瘤坏死因子-α蛋白免疫印迹分析 |
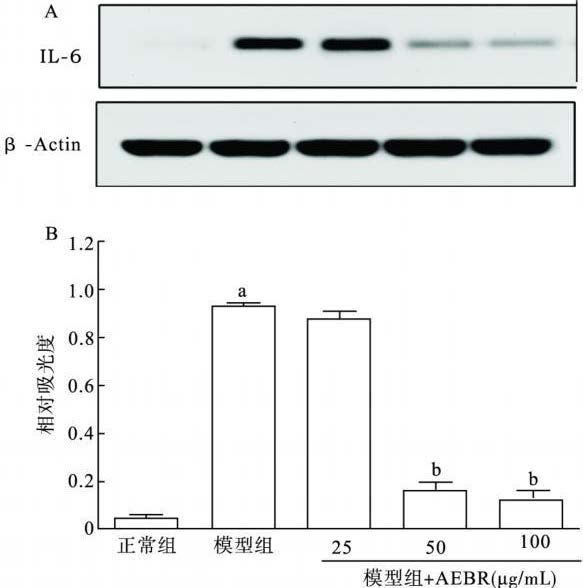
2.4 黑米花色苷提取物对IL-6蛋白表达影响(图 2)
电泳 条带吸光度分析显示,模型组IL-6 蛋白表达较对照组增加 10. 3倍,黑米花色苷提取物( 25、50、100 µg /L) 给药10 m in 使IL-6蛋白表达分别下降5. 6% 、77%与84. 1%。
|
注: 与正常组比较,a P < 0. 01; 与模型组比较,b P < 0. 01。 A: 蛋白免疫印迹; B: 光密度比较 图 2 不同组肥大细胞的白介素α6蛋白免疫印迹分析 |
变应原致敏机体后,机体免疫系统可对变应原进行识别 并产生特异性抗体IgE,IgE可与肥大细胞表面的IgE Fc 段受 体I ( Fc-RI)结合使细胞致敏,当机体再次接触变应原时,特 异性IgE可与其结合,从而诱导肥大细胞脱颗粒并释放多种 炎性介质[7]。有效地抑制肥大细胞脱颗粒就成为抗变态反 应药物研发的重点。
被抗原激活的肥大细胞脱颗粒以后,释放出TNF-α、IL-6 等与I型变态反应相关的细胞因子,引起过敏炎症反应[5]。 TNF-α 是重要的前炎症因子,它可促使血管内皮细胞表达黏 附分子促进炎症细胞聚集,并可刺激白三烯等因子释放。组 胺可增强多种细胞合成分泌IL-6等促炎细胞因子,促进过敏 炎症反应; 组胺还可增强嗜酸细胞和肥大细胞的趋化反应,诱 导炎症介质的生成,对炎症有促进作用[1]。据研究报道,调 节细胞内钙的浓度是抑制Fc-RI诱导肥大细胞脱颗粒的关键 因素[8]。本研究结果显示,黑米花色苷提取物剂量依赖性减 少IgE诱导的肥大细胞外钙内流,由此可抑制肥大细胞脱颗 粒和炎症细胞因子的释放。从体内及体外观察到黑米花色苷 提取物抑制了组胺、TNF-α、IL-6等与I型变态反应相关的因 子,这可能是黑米花色苷提取物抗I型变态反应的重要机制 之一。
| [1] | 黄丰,童晓云,张荣华,等.牛膝多糖对抗原诱导的肥大细胞活化的影响[J].中国药理学通报,2008,24(10):1302-1305. |
| [2] | Xia X,Ling W,Ma J,et al. Ananthocyan in rich extract from black rice enhances atherosclerotic plaque stabilization in apolipoprotein Edeficient mice[J].J Nutr,2006,136(8):2220-2225. |
| [3] | 郭红辉,胡艳,刘驰,等.黑米花色苷对果糖喂养大鼠胰岛素敏感性影响[J].中国公共卫生,2008,24(10):1200-1202. |
| [4] | Choi YH,Yan GH,Chai OH,et al. Inhibitory effects of Agaricus blaseion mast cell mediated an aphylax is like reaction[J].Biol Phamr Bull, 2006,29(7):1366-1371. |
| [5] | Choi YH,Yan GH.Silibin inattenuates mast cell mediated anaphylax is like reactions[J].Biol Pharm Bull, 2009,32(5):868-875. |
| [6] | Choi YH,Yan GH.Ellagic acid attenuates mimunoglobulin Emediated al.ergic response in mast cell[J].Biol Pharm Bull, 2009,32(6):1118-1121. |
| [7] | Kovarova M,Rivera J.A molecular und erstanding of mast cell activation and the promise of anti allergic therapeutics[J].Curr Med Chem,2004,11(15):2083-2091. |
| [8] | Janiszewski J,Huizinga JD,Blenn erhassett M G.Mast cell ionic channels:significance forst miulus secretion coupling[J].Can J Physiol Pharmacol, 1992,70(1):1-7. |
 2011, Vol. 27
2011, Vol. 27


