2. 安徽省立医院儿科
随着环境中过敏原增加,哮喘发病率不断攀升[1]。过敏炎症发生过程中机体内环境紊乱,免疫失衡机制尚不完全清楚。哮喘治疗最常用的药物是皮质激素,但其抑制免疫功能,副作用大,病情常反复发作。视黄酸( retino ic ac id,RA ) 是维生素A 的活性代谢产物,机体不可缺少的营养素,能加强和调整多种免疫细胞活性。研究表明,难治性哮喘肺炎的严重程度与体内RA 水平成反比[2],RA 缺乏组织修复迟缓。RA以加强巨噬细胞( m ac rophag es,M a) 功能活动为重要特征[3],通常人们仅注意M a在哮喘急性期的负面作用[4],RA 对慢性肺过敏性炎症中的非特异免疫功能的作用至今了解不多。为探讨M a影响肺过敏性炎症的机制,本研究采用大鼠持续吸入抗原激发哮喘,采用微量RA 与皮质激素雾化吸入干预,观察大鼠肺、胸腺、脾脏过敏性炎症特点。结果报告如下。
1 材料与方法 1.1 材料( 1) 试剂与仪器: 鸡卵清蛋白( OVA ),视黄酸( RA ) (美国S igm a公司); 分析纯石蜡油( 宜兴展望化工试剂厂) 作为RA 的溶媒; 皮质激素药物为布地奈德鼻喷雾剂(英国伦敦- 阿斯里康公司); 电子JEOL—1230型透射电子显微镜( 日本电子株式会社) ; CH 30 型O lympus显微镜( 日本O lym pus公司)。( 2)实验动物: 健康6 周龄SD大鼠47只,体重( 130±21) g(安徽医科大学实验中心,动物合格证: 皖医实动准字第01号)。
1.2 方法 1.2.1 大鼠致敏与分组正常对照组5只,常规喂养; 42只致敏模型大鼠采用10 g /L OVA,与10% 液态铝配成混悬液,分别于0、7 d大鼠腹腔内注射2 mL致敏,14 d后,1% OVA液超声雾化激发哮喘,每天1次30 m in,共30 d。激发23 d时,将致敏模型大鼠随机分为3 组,每组14只。石蜡油组使用石蜡油液; RA组使用RA 10µg /mL; RA + 皮质激素组使用10µg /mL RA+ 0 02%布地奈德。各组均于每次激发后间隔1~ 2 h超声雾化给药,30 m in /d; 连续给药7 d后,各组实验大鼠休息10 d。
1.2.2 光学显微镜观察分别于激发后30 d 和休息10 d后,动物颈椎脱臼,选取气管中下段、左肺中部横断面、脾脏头端横断面、胸腺实质最厚处组织用4%多聚甲醛固定、丙酮脱水,石蜡切片。( 1)苏木素- 伊红( HE) 染色: 和正常组比较,胸腺皮质、脾动脉周围淋巴鞘( T 细胞区) 与淋巴滤泡以淋巴组织的面积、细胞大小与密度评定增生状态; 400 倍镜下观察红髓细胞形态。( 2) 肺酸性非特异性酯酶( ANAE ) 染色及细胞计数: 肺泡M a深褐色,5个视野/每张切片,200倍光镜下计数。( 3)肺甲苯胺兰染色: 致敏细胞包括肥大细胞与嗜碱粒细胞,前者胞体大、含密集紫兰色颗粒,后者胞体小,含紫红色颗粒。10个视野/每张切片,400倍光镜下计数。
1.2.3 电子显微镜观察每组取3 只约2 mm3 近被膜处肺组织,用2.5%戊二醛磷酸盐缓冲液( PBS)固定,柠檬酸铅+醋酸铀双染。电镜下观察肺泡隔内各种类型细胞与终末细支气管上皮超微结构改变。
1.3 统计分析采用SPSS 10.0软件进行统计分析,结果以均数±标准差( x±s )表示; 2组间差异和3组间总差异采用秩和检验; 肺泡M a与致敏细胞的相关性分析采用Pearson's相关分析法。
2 结 果 2.1 大鼠一般状况激发后30~ 40 d时,各组大鼠呼吸有哮鸣音。石蜡油组大鼠神萎,毛发干枯,不喜动,体重较轻,为( 107±30) g; RA组大鼠精神尚可,较活跃,体重( 120±32) g,略有减轻; RA+ 皮质激素组哮鸣音较重,体重( 112±27) g。
2.2 电镜观察 2.2.1 肺泡主要细胞超微结构比较持续吸入OVA 30 d,各组均出现肺泡Ⅰ型、Ⅱ型上皮细胞与血管内皮细胞肿胀、空泡变性甚至凋亡,肺泡腔红细胞渗出。但RA组肺泡结构肿胀、空泡变性最轻,细胞线粒体大致结构完整; 休息10 d后,该组细胞超微结构恢复较好,提示RA 能在一定程度上稳定和保护细胞膜性结构。各组肺泡M a 的超微结构差异较大(图 1-3) ,石蜡油组与RA + 皮质激素组核染色质边集,胞质中残余体和空泡堆积,结构退化明显。RA 组细胞胞体大,胞质中多种细胞器,溶酶体和吞噬颗粒丰富,吞噬功能活跃。提示RA具活化肺泡M a的效应。
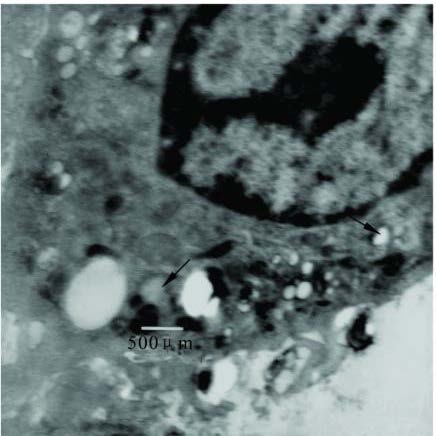
|
注: M a胞体较小, 胞质中多数是吞噬体( ↑ )和空泡, 溶酶体少,分泌小泡开始增多。 图 1 石蜡油组激发40 d 时电镜图(柠檬酸铅+醋酸铀双染; 放大倍数: 10K ) |
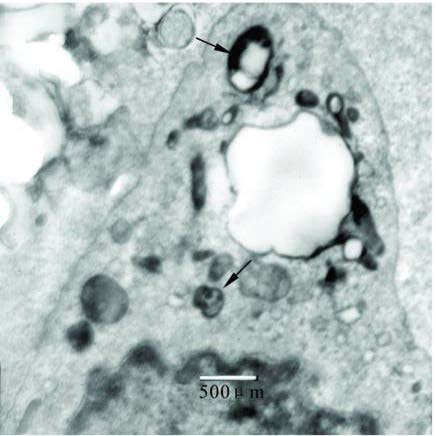
|
注: M a胞质中多数是残余体( ↑) 和空泡堆积 图 2 RA+ 皮质激素组激发40 d时电镜图(柠檬酸铅+醋酸铀双染; 放大倍数: 10K ) |
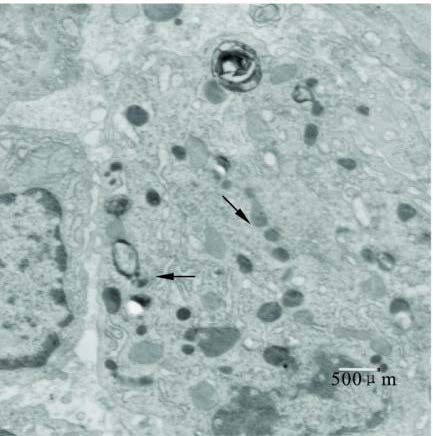
|
注: M a胞质丰富, 含有较多溶酶体( )和吞噬体, 出现滑体滑面内质网( ↑ )和分泌小泡开始增多。 图 3 RA组激发40 d时电镜图(柠檬酸铅+醋酸铀双染; 放大倍数: 10K ) |
电镜下可见,石蜡油组小气道上皮出现一些胞质泡沫状的杯状细胞。RA 组上皮内这种杯状细胞较多; RA+ 皮质激素组呼吸道上皮基本全部为泡沫状的杯状细胞,胞质含大量粘蛋白颗粒( 图 4)。
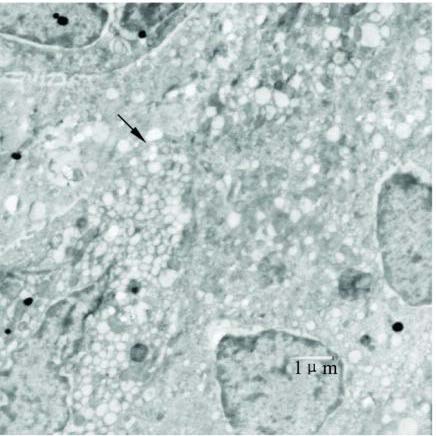
|
注: 呼吸道上皮细胞胞质泡沫状, 细胞器减少, 大量粘蛋蛋白颗粒( ↑ )。 图 4 RA + 皮质激素组激发40 d时电镜图(柠檬酸铅+ 醋酸铀双染; 放大倍数: 5K) |
致敏细胞包括嗜碱粒细胞与肥大细胞,前者数量多,大部分位于肺泡隔;后者少,主要位于气道与血管周围间质。表 1可见,激发30 d,3组大鼠肺泡M a组间总差异无统计学意义; 致敏细胞组间总差异有统计学意义( P < 0.01),其中RA 组、RA + 皮质激素组与石蜡油组比较,差异均有统计学意义(分别P < 0.01, P <0.05)。3组致敏细胞与肺泡M a 均呈负相关,但仅RA 组为负相关有统计学意义( P < 0.05)。提示给药期间,RA 活化肺泡M a的效应有抑制致敏细胞的作用,与促进肺泡M a吞噬功能有关。休息10 d后,3组致敏细胞与肺泡M a均增加,组间总差异和2组比较差异均无统计学意义; 除RA 组以外,其余2组肺泡M a 与致敏细胞均呈正相关(分别为石蜡油组r =0.933,P < 0.01; RA + 皮质激素组r= 0.7); 提示OVA 激发停止后,肺泡表面仍有大量抗原沉积,石蜡油组和RA+ 皮质激素组肺泡M a吞噬功能不良,抗原刺激引起致敏细胞增多。RA持久活化肺泡M a吞噬功能,是致敏细胞减少的主要原因。
|
|
表 1 3组大鼠肺泡M a与致敏细胞数量相关性比较(n= 7, x±s) |
组织学检查结果显示,从激发30 d后至休息10 d,石蜡油组胸腺皮质、脾白髓T细胞区和滤泡持续增生状态,后期滤泡增生较强; RA + 皮质激素组胸腺皮质增生,但胸腺被膜周围脂肪组织增加、实质萎缩; 后期脾脏主要为T 细胞区增生。RA 组激发30 d后,胸腺皮质、脾白髓主要是T 细胞区增生; 休息10 d后增生转弱。后期石蜡油组脾红髓出现很多胞质内含铁血黄素过度沉积的M a,其他2组则仅有个别大鼠存在类似现象,提示退化M a增多,常常伴随着脾滤泡增生。
3 讨 论
本研究观察结果显示,随激发时间推移,哮喘大鼠致敏细胞数量逐渐增加,与肺泡M a 呈正相关,肺泡M a呈现吞噬功能低下和分泌现象。研究表明,临床控制不良的儿童哮喘常常发生肺泡M a功能损害,表现为吞噬功能减少和细胞凋亡增加,提示非特异免疫功能削弱可加重过敏炎症[5]。A ttila等[6]研究显示,RA 可明显增加髓样细胞PPAR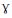 ( perox isom eproliferator-activ ated receptor ) 表达、清道夫受体( scavengerreceptor,CD36) 增多,促进M a 成熟,提示RA 明显增强肺泡M a非特异免疫能力,通过清除沉积抗原,减少对肺泡上皮刺激,因此可减少致敏细胞产生。
( perox isom eproliferator-activ ated receptor ) 表达、清道夫受体( scavengerreceptor,CD36) 增多,促进M a 成熟,提示RA 明显增强肺泡M a非特异免疫能力,通过清除沉积抗原,减少对肺泡上皮刺激,因此可减少致敏细胞产生。
有研究显示,在患有鼻炎或哮喘的猫的气管洗出液中,轻至中等程度含铁血黄素沉积的M a 发生率分别达85.7% 或71.4%,这种细胞增加,与吸入气源性过敏原有关[7]。本研究中3组大鼠在光镜下均未见大鼠肺泡M a胞质内含铁血黄素沉积,但石蜡油组脾红髓出现大量含铁血黄素过度沉积的M a,其他2组仅个别大鼠有此类现象。通常含铁血黄素是M a吞噬红细胞处理后沉积在胞质内的残余物,过多沉积表明已转化为退化细胞,同时该组肺泡M a吞噬泡与残余体多、溶酶体少,也属退化细胞,提示肺脏、脾脏中的退化M a 是诱发机体不良内环境的重要因素,可能加重过敏炎症。
难治性哮喘存在M a功能缺陷与RA缺乏2种因素,适当补充RA 可以纠正内环境紊乱[8]。本研究结果表明,RA 能在一定程度上稳定和保护细胞膜性结构,提高非特异免疫能力,这可能与RA 可增加细胞膜三磷酸腺苷( ATP) 酶活性有关[3]。RA 是组织修复不可缺少的营养素,大鼠长期吸入抗原,肺组织损伤严重,过多消耗RA,若及时补充,应有利于细胞结构恢复。因此,RA 可用于激素耐药的哮喘患者辅助治疗,给药途径和剂量有待进一步探讨。
| [1] | 周晓彬,纪霞,葛云洁,等.成人哮喘影响因素的病例对照研究[J].中国公共卫生,2006,22(9):1093-1094. |
| [2] | Arora P,Kumar V,Batra.Vitamin Astatus in children with asthma[J].Pediatr Allergy Immunol, 2002,13(3):223-226. |
| [3] | 楼皖玲,潘家华,何金根,等.亚临床缺乏维生素A伴哮喘大鼠免疫功能低下与膜ATPase活性的关系[J].四川生理科学杂志,2007,29(4):160-162. |
| [4] | Yang M,Kumar RK,Foster PS.Interferon gamma and pulmonary macrophages contribute to themechanisms underlying prolonged air way hyperrespon siveness[J].Clin Exp Allergy,2010;40(1):163-173. |
| [5] | Fitzpatrick AM,Holgu in F,Teague WG,et al. Alveolar macrophage phagocytosis is impaired in children with poorly controlled asthma[J].J Allergy Clinm Imunol, 2008,121(6):1372-1378. |
| [6] | Attila S,Laszlo N.Retinoids potentiate peroxisome proliferator actirated receptoraction in differentiation,gene expression,and lipidmetab olicprocesses in developingmyeloid cells[J].Mol Pharmacol,2005,67(6):1935-1943. |
| [7] | DeHeer HL,McManus P.Frequency and severity of tracheal wash hemosiderosis and association with underlying disease in 96 cats:2002-2003[J].Vet Clin Pathol, 2005,34(1):17-22. |
| [8] | Uematsu S,Fujmioto K,Jang MH,et al. Regulation of humoral and cellular gut mimunity by lamina propria dendritic cells expressing Toll like receptor 5[J].Nat Immunol, 2008,9(7):769-776. |
 2011, Vol. 27
2011, Vol. 27
