2. 郑州大学公共卫生学院流行病学教研室;
3. 河南省分子医学重点实验室(郑州大学)
志贺菌属( Sh ige lla )是感染性腹泻的重要病原[1],随着抗 生素的广泛使用,临床治疗中频繁出现耐药志贺菌属菌株,甚 至呈现为耐多药( m ulti-drug resistance,MDR ) 菌。耐多药志 贺菌引起的感染不仅在发展中国家,在发达国家也成为影响 临床治疗的关键因素[2]。抗性基因的水平转移,是目前人们 认为临床耐多药株产生的主要原因。近年研究发现,整合子 系统也参与了耐药基因的传播,整合子- 耐药基因盒系统与 志贺菌属耐多药性有关[3]。整合子在不同种属细菌的分布 及不同地区检出率报道不一,以往国内外对志贺菌属整合子 的研究报道以2 类整合子较为多见,但近年在志贺菌属中发 现了非典型1类整合子[4, 5]。为了观察志贺菌属中非典型1 类整合子的耐药性及其分子生物学特点,本研究对90株志贺 菌属临床分离株进行了非典型1类整合子耐药基因盒及耐多 药性检测分析。结果报告如下。
1 材料与方法 1.1 材料( 1) 菌株: 志贺菌属临床分离株90株(本研究室 保存) ,其中郑州铁路中心防疫站惠赠江西省铜鼓县1995- 1996年福氏志贺菌11 株; 1998- 2001 年河南省郑州市分离 的福氏志贺菌5株、宋内志贺菌6株; 河南省疾病控制中心惠 赠商丘市睢县2004- 2006年福氏志贺菌67株、宋内志贺菌1 株。药敏试验质控菌为大肠埃希菌ATCC25922(本研究室保 存)。( 2)主要试剂: 氨苄青霉素( AMP) 、四环素( TET) 、甲氧 苄啶/磺胺甲噁唑( SXT) 、氯霉素( CHL)、萘啶酸( NAL )、环丙 沙星( CIP)、庆大霉素( GEN) 和头孢唑林( CFZ)药敏纸片( 北 京天坛药物生物技术开发公司) ; 细菌基因组DNA 小提试剂 盒(中国杭州Axyg en 公司); 10 × dNTPs、TaqDNA 聚合酶和 DNA m arke rDL2000,包括100、250、500、750、1000、2000 bp片 段( 大连TaK aRa 公司); 限制性内切酶H ind ( 立陶宛M BI Ferm ents公司)。
1.2 方法 1.2.1 药敏实验参照美国临床实验室标准化协会( CLS I) 颁布的抗微生物药物敏感性试验操作方法和判断标准,采用 纸片扩散法( d isk d iffusion testing )检测菌株的耐药性。
1.2.2 PCR扩增针对非典型1 类整合子的耐药基因盒区 域[4],上游引物位于1类整合子的5'端保守区,hep58: 5'-GCA TCC AAG CAG CAA GC-3' ; 下游引物是针对非典型1类整合 子3'末端插入序列IS ( insertion sequence) 设计的ISVR: 5'- AAC ACC GAC AGG GAT GGA-3'。用试剂盒提取细菌基因组 DNA 为模板,进行PCR扩增,扩增体系按常规方法[6]进行。 扩增条件: 94 ℃ 预变性5 m in后,94 ℃ 变性30 s,68 ℃ 退火30 s,72 ℃ 延伸4 m in,退火温度每个循环降低1 ,共12 个循 环,直至57 ℃ ,然后94 ℃ 变性30 s,56 ℃ 退火30 s,72 ℃ 延 伸4 m in,进行30个循环,最后72 ℃ 延伸5 m in。挑选代表菌 株将凝胶回收后的PCR扩增产物进行测序,引物合成和序列测定均由北京博尚生物工程公司完成。
1.2.3 限制性片段长度多态性( RFLP) 分析对所有PCR 扩增产物进行H ind 酶切反应,酶切体系按说明书进行, 37 ℃ 水浴4 h,加入2 μL的10 × load ing buffer终止反应。酶 切产物用1%琼脂糖凝胶电泳分离,片段长度大小相同且酶 切图谱相同的整合子可变区PCR 扩增产物被认为具有相同 的序列。分析比较非典型1类整合子阳性组与阴性组菌株对 AM P-TET-CHL的联合耐药率。
1.3 统计分析测序结果用GenBank数据库B lastn软件检 索并分析; 采用SPSS 12. 0软件进行统计分析,联合耐药率比 较使用x2 检验。
2 结 果 2.1 抗生素耐多药率90株志贺菌属中对 3种抗生素耐 药的耐多药菌株有86株,占95. 6%; 其中福氏志贺菌83株, 均为耐多药菌株; 7 株宋内志贺菌中3 株为耐多药株。常见 耐药谱为耐AMP-TET-SXT-CHL-NAL,占34. 4% ( 31 /90),其 次是耐AMP-TET-SXT-CHL-NAL-CIP,占18. 9% ( 17 /90); 90 株中对AMP-TET-CH L联合耐药的有66株,占73. 3%。
2.2 PCR扩增、酶切与测序( 图 1,图 2)90 株志贺菌属分离 株中,经PCR 扩增出非典型1类整合子耐药基因盒阳性片段 65株,占72. 2% 。测序分析结果显示,代表菌株的非典型1 类整合子耐药基因盒序列为b laoxa-30-aadA1( GenBank 登录号 GQ214137) ,长度为2 140 bp,限制性内切酶H ind 可以将其 分为1 086 bp和1 054 bp 2段。RFLP分析结果显示,所有酶 切产物的带型均一,约为1 000 bp片段,提示所有PCR扩增 产物为相同序列片段。
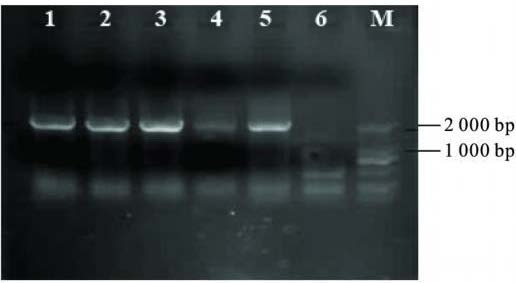
|
注: 1~ 5: 非典型1类整合子耐药基因盒的PCR扩增产物; 6: 阴性对照; M: 标准分子质量DNA DL2000 ladder。 图 1 非典型1 类整合子耐药基因盒的PCR 扩增产物 |
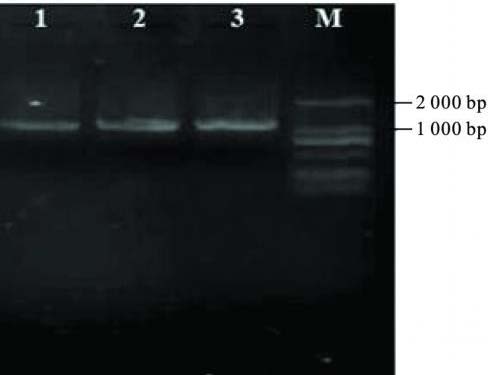
|
注: 1 ~ 3: 非典型1类整合子b laoxa-30-aadA1经H ind酶切产物; M: 标准分子质量DNA DL2000 ladder。 图 2 非典型1类整合子b laoxa-30-aadA1经H ind酶切结果 |
在非典型1类整合子耐药基因盒b laoxa-30-aadA1 阳性菌株中,对AM P-TET-CHL 的联合耐药率占 81. 5%,高于阴性菌株的52. 0%,经双侧x2 检验结果显示,差 异有统计学意义( P < 0. 05)。
|
|
表 1 志贺菌属非典型1类整合子耐药基因盒b laoxa-30-aadA1与AM P-TET-CHL联合耐药 |
本研究应用hep58作为上游引物,应用针对非典型1 类 整合子3'末端插入序列IS设计的反向引物ISVR作为下游引 物进行PCR 检测,结果显示,b laoxa-30-aadA1 的阳性率为 72. 2%,与既往研究结果一致。2006 年Pan等[4]观察来自中 国的31株宋内志贺菌和33 株福氏志贺菌中,非典型1类整 合子的阳性率分别为3. 2%和84. 9%; 随后2007年法国[5]对 来自世界四大洲多个国家的68株志贺菌属研究发现,23株1 类整合子整合酶基因intI1阳性菌株中,22株呈现出相同的非 典型1类整合子结构。
最早有关非典型1类整合子的报道见于1997年日本学 者[7]对福氏志贺菌YSH 6000 的一段染色体基因进行克隆分 析,发现这段基因包括了intI1、b laoxa-30-aadA1、插入序列以及 与CHL、TET耐药相关的耐药基因盒catA、tetA等,可以介导 对链霉素、CH L、TET 和AMP的耐药性。这段染色体序列被 称作志贺菌属耐药性位点SRL ( Shigella resistance lo cus, SRL) 。本研究结果显示,非典型1 类整合子阳性与AMP- TET-CHL 的联合耐药有关。提示耐药基因盒b laoxa-30-aadA1 介导的耐药性仅针对AM P和链霉素,而非典型1类整合子阳 性菌株对TET和CHL的耐药可能来自于SRL结构中的其他 耐药基因的作用。
作为SRL结构的一部分,非典型1类整合子对志贺菌属 耐多药性的影响可能不仅限于其携带的耐药基因盒。研究表 明,志贺菌属SRL结构位于一个66 kb长的致病岛PA I( path ogen icity island,PAI) 中[8],两者关系密切[9],简称为SRL PAI。SRL PAI结构可以通过同源重组蛋白Rox[10]或者整合 酶[11]介导的特异性重组,实现从染色体基因上的切除或者插 入。因此,非典型1类整合子可能参与SRL PAI结构的移动, 从而与志贺菌属耐多药性的产生和传播关系密切,它对志贺 菌属耐多药性产生影响的分子机制值得关注。另外,对SRL 的分子流行病学研究[9]表明,SRL 只出现在志贺菌属中。而 非典型1类整合子迄今为止也仅发现于志贺菌属中。因此, 非典型1 类整合子可以作为一个分子标志物,对于监测分析 志贺菌属耐多药性的分布传播具有重要意义,志贺菌属非典 型1类整合子与其耐多药性有密切关系及其分子机制尚需进 一步研究探索。
| [1] | Kotloff K L,Winickoff JP,Ivanoff B,et al. Global burden of Shigella in fections:miplications for vaccine development and miplementation of cont rol strategies[J].Bull WHO,1999,77(8):651-666. |
| [2] | Sivapalasingam S,Nelson JM,Joyce K,et al. High prevalence of an tmiicrobial resistance among Shigellaisolates in the United States tested by the national antimicrobialresis tance monitoring system from 1999 to 2002[J].Ant miicrob Agents Chemothe,r2006,50(1):49-54. |
| [3] | Peirano G,Agerso Y,Aarestrup FM,et al. Occurrence of in tegrons and resistance genes among sulphonam ideresistant Shigella spp. from Brazil[J].J Antimicrob Chemother,2005,55(3):301-305. |
| [4] | Pan JC,Ye R,Meng DM,et al. Molecular characteristics of class 1 and class 2 integrons and their relation ships to antibiotic resistance in clinical isolates of Shigella sonnei and Shigella flexneri[J].J Antimicrob Chemothe,r2006,58(2):288-296. |
| [5] | Dubois V,ParizanoM P,Arpin C,et al. High genetics tability of in tegrons in clinical isolates of Shigella spp.of world wideorigin[J].Antmiicrob Agents Chemother,2007,51(4):1333-1340. |
| [6] | 黄志刚,宋春花,范清堂,等.幽门螺杆菌cagA基因对胃癌细胞影响[J].中国公共卫生,2007,23(4):463-465. |
| [7] | Rajakumar K,Bulach D,Davies J,et al. Identification of a chromo somal Shigella flexneri multi antibiotic resistance locus which shares sequence and organizationals miilarity with the resistance region of the plasmid NR1[J].Plasmid,1997,37(3):159-168. |
| [8] | Luck SN,Turner SA,Rajakumar K,et al. Ferric dicitrate tran sport system(Fec)of Shigella flexneri-a YSH 6000 is encoded on anovel pathogenicity island carrying multiple antibiotic resis tancegenes[J].Infect Immun,2001,69(10):6012-6021. |
| [9] | Turner,SA,Luck SN,S akellaris H,et al. Molecular epidemiology of the SRL path ogenicity island[J].Antmiicrob Agents Chemother,2003,47(2):727-734. |
| [10] | Luck SN,Turner SA,Rajakumar K,et al. Excision of the Shigella resistan celocus pathogenicity is land in Shigella flexneri is stmiulated by a member of a new subgroup of recomb in ation directionality factors[J].J Bacteriol, 2004,186(16):5551-5554. |
| [11] | Turner SA,Luck SN,Sakellaris H,et al. Role of att P in in tegrase mediated integration of the Shigella resistan celocus pathogenicity is land of Shigella flexneri[J].Ant miicrob Agents Chemother,2004,48(3):1028-1031. |
 2011, Vol. 27
2011, Vol. 27


