2.吉林出入境检验检疫局;
3.上海生物芯片有限公司
志贺菌(Shigella,SHI) 、金黄色葡萄球菌(Staphylococcus aureus,SA) 、单核细胞增生李斯特菌(Listeria monocytogenes,LM) 、大肠杆菌O 157(Escherichia coli O 157,O 157) 是引起肠道疾病和危害食品安全的常见病原菌。目前对这些病原菌的检测主要依靠传统的国标方法进行细菌学培养,需要经过生化和血清学等多个步骤的检测,一般需3 ~ 5 d,操作繁琐,耗时费力,灵敏度低〔1〕,因此,有必要建立快速有效的检测方法。多重PCR 方法可对多种细菌同步进行快速有效的检测,因此,多重PCR 方法检测多种细菌成为近年来细菌快速检测方法的研究热点〔2, 3, 4〕。本研究建立同时检测志贺菌、金黄色葡萄球菌、单核细胞增生李斯特菌、大肠杆菌O 157 的多重 PCR 检测方法,对肠道疾病的控制及各类食品的检验提供了良好的检测手段,具有较高的实际应用价值。
1 材料与方法 1.1 材料 1.1.1 菌种及来源副溶血性弧菌(ATCC 17802 标准株) 、 普通变形杆菌(ATCC 33420 标准株) 、腊样芽孢杆菌(ATCC 11778 标准株) (北京中原公司) 。金黄色葡萄球菌(分离株) 、单核细胞增生李斯特菌(ATCC 19111 标准株) 、沙门菌 (ATCC 13311 标准株) 、志贺菌(分离株) 、产气荚膜梭菌(分离株) 、空肠弯曲菌(ATCC 33291 标准株) 、大肠杆菌O 157 (分离株) (吉林出入境检验检疫局实验室) 。
1.1.2 主要试剂DNA 提取试剂盒: EasyPureTM Genomic DNA Extraction KIT、PCR 试剂: 2 × Easy Taq PCR SuperMix、 Takara TaqTM Hot start version、100 bp DNA Ladder Marker(大连宝生物公司) ; 营养琼脂(nutrient agar,NA) 培养基、胰酪胨大豆琼脂培养基(tryptose soya agar,TSA) 血平板、溶菌肉汤 (luria-bertani,LB) 液体培养基,营养琼脂、革兰阴性(gram negative,GN) 增菌液均为(北京陆桥技术有限责任公司成品配制) 。
1.1.3 主要仪器Binder 恒温培养箱(德国binder 公司) 、 Shellab 厌氧培养箱(美国Shellab 公司) 、Shellab 水浴箱(美国 Shellab 公司) 、Biometra PCR 仪(德国Biometra 公司) 、Alphalmager EC 紫外成像系统(美国Alpha 公司) 。
1.2 实验方法 1.2.1 菌种扩增志贺菌和大肠杆菌O 157 用NA 培养基 37 ℃过夜培养,然后挑取3 ~ 4 个菌落接种到LB 液体培养基,在培养箱经过37 ℃培养24 h,提取DNA。金黄色葡萄球菌用TSA 血平板37 ℃过夜培养,取3 ~ 4 个菌落接种到LB 液体培养基,37 ℃培养24 h,提取DNA。单核细胞增生李斯特菌用TSA 血平板35 ℃培养24 h,取3 ~ 4 个菌落接种到LB 液体培养基,35 ℃培养24 h,提取DNA。
1.2.2 细菌DNA提取细菌DNA 的提取按照EasyPureTMGenomic DNA Extraction KIT 试剂盒使用说明中的操作规程进行提取。
1.2.3 引物设计按照引物设计原则,设计特异性引物。根据志贺菌ipaH 基因设计上游引物5'-ACCATGCTCGCAGAGAAACT-3',下游引物5'-CTTCTGACCATAGCTTCGGC-3'; 根据李斯特菌hlyA 基因设计上游引物5'-CATCCATGGCACCACCAGC-3'、下游引物5'-TGGCGGCACATTTGTCACTGC-3'; 根据大肠杆菌O 157 hlyA 基因设计上游引物5'-CAGTAGGGAAGCGAACAGAG-3' 、下游引物5'-AAGCTCCGTGTGCCTGAAGC-3'; 根据金黄色葡萄球菌nuc 基因的序列设计上游引物5'-TAAAGCGATTGATGGTGATACG-3' 、下游引物5'-AGCCAAGCCTTGACGAACTA-3'。 使用BLAST 程序,通过GenBank,对各引物及扩增产物同源性进行比对,以检测可能的重复序列,保证引物与靶基因结合的高度特异性。
1.2.4 单基因PCR 扩增先对4 种菌进行单独扩增,反应体系: 模板DNA 2μL,上、下游引物各2 μL(10μmol /L) ,2 × Easy Taq PCR SuperMix 25μL,ddH2O 19μL 总体积50μL。 PCR 扩增条件: 预变性95 ℃ 3 min,每个循环条件为95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,34 循环,产物末端 72 ℃延伸10 min。PCR 扩增产物电泳检测,并对扩增产物进行核甘酸序列测定,与Genbank 中相应序列进行比较。
1.2.5 多重PCR 扩增及优化 1.2.5.1 设计正交试验进行3 水平4 因素试验优化多重 PCR 反应体系,为了达到理想的多重PCR 扩增效果,根据 PCR 反应体系中Taq 酶(0.4、0.5、0.6 μL) 、三磷酸脱氧核糖核苷(deoxy-ribonucleoside triphosphate,dNTP ) (6.0、8.0、 10.0μL) 、Mg2+ (0、0.1、0.2μL) 、引物(0.8、1.0、1.2μL) 4 个因素设计不同的3 种水平,从而得到9 种不同的多重PCR 反应体系组合,从中找出最佳多重PCR 反应体系。除了上述4 因素外,在总体50 μL 反应体系中,10 × Buffer 加5 μL,4 种细菌的模板DNA 各加3 μL,用ddH2O 补足50 μL 反应体系。 多重PCR 扩增条件: 预变性95 ℃ 3 min,每个循环条件为 95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,34 循环,产物末端72 ℃延伸10 min。
1.2.5.2 退火温度优化采用温度梯度PCR 设定退火温度分别为58、59、60、61、62、63、64、65 ℃。引物浓度采用 1.2.5.1 中的最佳浓度,确定最佳退火温度。
1.2.6 多重PCR 特异性和敏感性检测 1.2.6.1 多重PCR 特异性检测分别提取志贺菌、金黄色葡萄球菌、单核细胞增生李斯特菌、沙门菌、副溶血性弧菌、空肠弯曲菌、产气荚膜梭菌、普通变形杆菌、腊样芽孢杆菌、大肠杆菌O 157 的基因组DNA,同时加入本次研究的4 种细菌对应的特异性引物进行多重PCR 扩增,以检测多重PCR 的特异性。
1.2.6.2 多重PCR 灵敏度检测将4 种细菌37 ℃24 h 培养后,将其菌悬液10 倍递增稀释“10 ~ 109”倍,按1.2.2 所述方法提取DNA,按照正交试验优化后的反应条件进行多重PCR 检测,同时对稀释的菌悬液分别取1 mL 倾注平板37 ℃培养进行菌落计数,多重PCR 能检出的最低细菌浓度为该体系的灵敏度。
1.2.7 人工模拟乳制品携带细菌的检测购买市面上出售的牛奶,经高压灭菌后,将4 种菌的菌悬液任选3 种随机加入牛奶中,过夜培养。提取基因组DNA,进行多重PCR 检测。
2 结 果 2.1 单重PCR 扩增(图 1)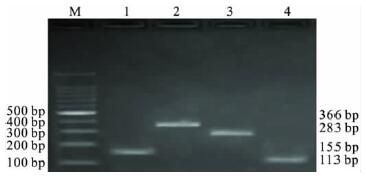 | 注: M: 100 bp DNA Ladder Marker; 1: LM; 2: O157; 3: SA; 4: SHI。 图 1 单重PCR 目的基因DNA 电泳图 |
对选定的各自目的菌株,用编码志贺菌ipaH 基因的引物进行PCR,结果扩增出大小约为 113 bp 的特异性片段,用编码单核细胞增生李斯特菌hlyA 基因的引物进行PCR,扩增出大小约为155 bp 的特异性片段,用编码大肠杆菌O 157 的hlyA 基因的引物进行PCR,扩增出大小约为366 bp 的特异性片段,用编码金黄色葡萄球菌nuc 基因的引物进行PCR,扩增出大小约为283 bp 的特异性片段。通过核苷酸序列测定,与Genbank 中公布的基因序列同源性> 98%。
2.2 多重PCR 扩增优化结果 2.2.1 正交试验结果通过正交试验设计得到本次多重 PCR 试验的最佳体系,即在50.0 μL 反应体系中,Taq 酶添加 0.6 μL,Mg2+添加0.2μL,4 种菌的上游引物各添加0.8 μL,下游引物各添加0.8 μL,dNTP 添加8.0 μL,10 × Buffer 添加5 μL,4 种菌的模板DNA 各添加3 μL,ddH2O 添加17.8 μL。
2.2.2 多重PCR 退火温度的优化(图 2)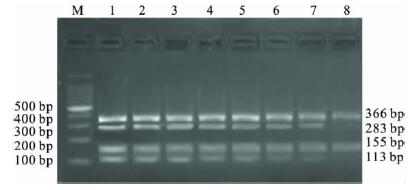 |
注: M: 100 bp DNA Ladder Maker; 1: 58 ℃; 2: 59 ℃; 3: 60 ℃; 4: 61 ℃; 5: 62 ℃; 6: 63 ℃; 7: 64 ℃; 8: 65 ℃。 图 2 多重PCR 不同退火温度电泳图 |
根据58、59、60、 61、62、63、64、65 ℃进行温度梯度PCR 后,结果显示第1 泳道电泳条带最亮,显示退火温度58℃为最佳。
2.3 多重PCR 特异性检测加入10 种细菌DNA,同时加入本次研究的4 种细菌对应的特异性引物进行多重PCR 扩增,结果显示只有单增李斯特菌、志贺菌、大场杆菌O 157、金黄色葡萄球菌扩增出现特异条带,而其他6 种细菌均为阴性。
2.4 多重PCR 灵敏度检测(图 3)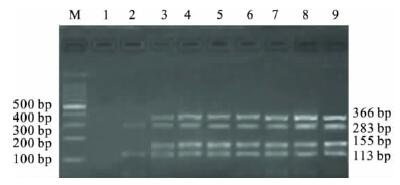 |
注: M: 100 bp DNA Ladder Maker; 1: 1.8 × 101 cfu /mL; 2: 1.8 × 102 cfu /mL; 3: 1.8 × 103 cfu /mL; 4: 1.8 × 104 cfu /mL; 5: 1.8 × 105 cfu /mL; 6: 1.8 × 106 cfu /mL; 7: 1.8 × 107 cfu /mL; 8: 1.8 × 108 cfu /mL; 9: 1.8 × 109 cfu /mL。 图 3 多重PCR 灵敏度电泳图 |
对培养后的菌悬液10 倍递增稀释“10 ~ 109”倍后进行多重PCR,结果第3 泳道稀释 107 倍时能够同时检测出4 种细菌。根据菌落计数结果,显示本研究中4 种细菌多重PCR 检测的灵敏度为1.8 × 103 cfu /mL。
2.5 市售牛奶人工模拟染菌检测(图 4)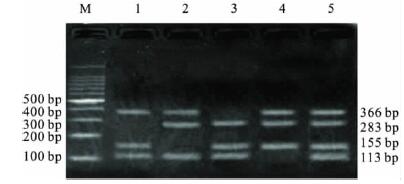 |
注: M: 100 bp DNA Ladder Marker; 1: SHI、LM、O157; 2: SHI、SA、O157; 3: SHI、LM、SA; 4: LM、SA 、O157; 图 4 多重PCR 检测牛奶中细菌 |
对市售牛奶经高压灭菌后人工随机染菌进行多重PCR 检测,结果显示多重 PCR 能够有效地扩增出相应的目的基因片段,从而识别出随机接种的任意3 种细菌。
3 讨 论多重PCR 由于在单个反应体系中加入了不同的目的片段和特异性引物,所以需要对反应体系进行优化才能得到较好的扩增效果。正交试验设计就是对多重PCR 反应体系中各成分的比例进行优化设计的有效方法之一。Dabrowski〔5〕、 郝玉芹〔6〕、代娟〔7〕等人通过正交实验设计对多重PCR 反应体系进行了优化,取得了良好效果。本研究在4 种病原菌多重 PCR 体系优化设计中采用了正交设计的方法,结果表明正交试验设计能够快速、有效地得到多重PCR 反应体系中各成分的最优组合,节省了人力和物力。
PCR 产物的特异性取决于引物与模板DNA 互补的程度,本研究中的多重PCR 方法由于加入了不同细菌目的基因的特异性引物,扩增出特异性目的片段,在实际应用中具有特异性强的特点。
本研究检测的灵敏度与沙丹等〔8〕研究的多重PCR 灵敏度接近,高于Fujuoka〔9〕和钱玉春等〔10〕研究的多重PCR 的灵敏度,这可能与试验种细菌之间的相互抑制以及PCR 体系中各成分比例、循环参数等有关。
多重PCR 方法与传统细菌培养的方法比较具有特异性高、准确、快速、经济简便的优点,与普通PCR 方法比较具有通量较高的优点。多重PCR 方法的研究对及时判定病原菌、 有效控制病原菌传播、预防食物中毒的发生具有重要意义。
| 〔1〕 | 邵晖,吴玲玲,王伟,等.食品中病原微生物检测方法进展及优缺点评价[J].中国食品工业,2008,23(4):40-43. |
| 〔2〕 | Aranda KR,Fagundes-Neto U,Scaletsky IC.Evaluation of multiplex PCRs for diagnosis of infection with diarrheagenic Escherichia coli and Shigella spp[J].Journal of Clinical Microbiology,2004,42 (12):5849-5853. |
| 〔3〕 | O’Leary J,Corcoran D,Lucey B.Comparison of the EntericBio multiplex PCR system with routine culture for detection of bacterial enteric pathogens[J].Journal of Clinical Microbiology,2009,47 (11):3449-3453. |
| 〔4〕 | Kurabachew M,Engerφ,Sandaa RA,et al.A multiplex polymerase chain reaction assay for genus-,group-and species-specific detection of mycobacteria[J].Diagn Microbiol Infect Dis,2004,49(2): 99-104. |
| 〔5〕 | Dabrowski W,Czekajlo-Kolodziej U,Medrala D,et al.Optimisation of AP-PCR fingerprinting discriminatory power for clinical isolates of Pseudomonas aeruginosa[J].FEMS Microbiol Lett,2003,218 (1):51-57. |
| 〔6〕 | 郝玉芹,孙皆宜,李艾,等.正交优化多重PCR反应体系检测3种食源性致病菌的研究[J].安徽农业科学,2010,38(2):602-605. |
| 〔7〕 | 代娟,李玉峰,杨潇.肠道致病菌多重PCR快速检测体系研究[J].中国公共卫生,2007,23(2):219-200. |
| 〔8〕 | 沙丹,凌霞,肖勇,等.三种食源性致病菌多重PCR检测方法的建立及初步应用[J].检验医学,2009,24(3):177-181. |
| 〔9〕 | Fujioka M,Kasai K,Miura T,et al.Rapid diagnostic method for the detection of diarrheagenic Escherichia coli by multiplex PCR[J]. Jpn J Infect Dis,2009,62:476-480. |
| 〔10〕 | 钱玉春,类延花,胡中旺.4种食源性致病菌的多重PCR检测方法的建立[J].中国卫生检验杂志,2009,19(9):2042-2045. |
 2011, Vol.27
2011, Vol.27


