2. 成都市儿童医院检验科
肺炎链球菌(Streptococcus pneumoniae,S. p ) 在世界范围内仍然是一种重要的病原体,可引起肺炎、脑膜炎、中耳炎、鼻窦炎及菌血症等多种严重疾病〔1, 2〕。为了及时准确地检测出疑似病例是否为肺炎链球菌感染,需要有灵敏特异的检测方法。虽然从样本中分离到肺炎链球菌被公认为是金标准,但实际在肺炎链球菌性肺炎的成人病例中,能够分离到菌株的只占20% ~ 30%,在儿童病例中< 10%。通常用于检测肺炎链球菌抗原和抗体的血清学方法,均缺乏一定的灵敏度和特异度〔3〕。与培养方法相比,PCR 方法有很多优越性,敏感性高;能够扩增很多与链球菌相关的基因序列; 可以从死亡的微生物或污染的样本中检测出细菌DNA〔3, 4〕。本研究采用PCR 扩增方法拟对自溶素基因(lytA) 和溶血素基因(ply) 进行检测,探讨对肺炎链球菌性感染病例检出的灵敏度和特异度。
1 材料与方法 1.1 菌株与培养基161株疑似肺炎链球菌分离自2004 年1 月- 2007 年10 月在四川省成都市儿童医院治疗的呼吸系统感染患儿。31 001标准株,为前苏联国家检定所检定(中国药品生物制品检定所) 。血琼脂平板(津章生物科技开发公司) 。
1.2 主要仪器与试剂Robocycler®Gradient 40 型PCR 基因扩增仪(美国Stratagene 公司) ,UVIpro GAS 7001 X 凝胶影像分析系统(英国UVI 公司) ,DYY-2 C 电泳仪(北京市六一仪器厂) 。硅胶膜型TM基因组DNA 提取试剂盒(北京赛百盛基因技术有限公司) ,用于提取肺炎链球菌基因组DNA。蛋白酶 K、溶菌酶、Taq酶和10 × PCR buffer(日本TaKaRa公司) 。
1.3 细菌的培养与鉴定开启肺炎链球菌保存管,吸取5 μL 保存液接种于血平板上,置于37 ℃、5% CO2 培养箱中过夜培养。第2 d 挑取形态典型的单个肺炎链球菌菌落,转种于另一血平板进行大量培养,同时将31 001标准株也接种于血平板上,培养条件同上。第3 d 进行奥普托欣敏感性和胆汁溶解试验。首先刮取第2 d 转种的血平板上的菌苔均匀涂布于一新血平板下半部,将31 001标准株涂于同一血平板的上半部; 然后将直径6 mm 的5 μg 奥普托欣纸片分别放在血平板上、下两部的中间处,将血平板置于CO2 孵箱中,37 ℃培养 18 ~ 24 h。如果一个疑似菌株生长抑制区≥16 mm 时,即为肺炎链球菌; 生长抑制区< 16 mm,需要进行胆汁溶解试验来确认,若胆汁试验阳性可确定为肺炎链球菌。
1.4 PCR 反应根据已知肺炎链球菌国际通用标准株,即无致病性的野生R 6 株的lytA 和ply 基因序列设计引物,由北京赛百盛基因技术有限公司合成。lytA 基因中273 bp 片段的引物序列,F: 5'-TGAAGCGGATTATCACTGGC-3',R: 5'-GCTAAACTCCCTGTATCAAGCG- 3'。25 μL PCR 反应体系中,各成分的终浓度分别为: DNA 模板20 ng /μL,dNTP 200 μmol /L,1 × PCR buffer,lytA 引物0.5 μmol /L,Taq 酶0.05 U/μL。反应条件为: 94 ℃预变性5 min; 随后进行30 个循环的扩增,94 ℃ 变性15 s,50 ℃退火30 s,70 ℃延伸30 s; 最后70 ℃终末延伸 10 min。
ply 基因中348 bp 片段的引物序列,F: 5'-ATTTCTGTAACAGCTACCAACGA- 3',R: 5'-GAATTCCCTGTCTTTTCAAAGTC- 3'。25 μL PCR 反应体系中,各成分的终浓度分别为: DNA 模板20 ng /μL,dNTP 200 μmol /L,1 × PCR buffer,ply 引物0.5 μmol /L,Taq 酶0.05 U/μL。反应条件为: 94 ℃预变性5 min; 随后进行30 个循环的扩增,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s; 最后72 ℃终末延伸10 min。
2 结 果 2.1 疑似肺炎链球菌的鉴定对分离自成都市儿童医院的 161 株疑似肺炎链球菌经奥普托欣敏感性和胆汁溶解试验后,结果显示,共有146 株为肺炎链球菌,另15 株为草绿色链球菌。
2.2 lytA 基因的PCR 扩增(图 1)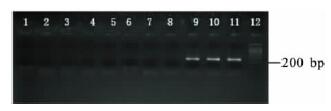 |
注: 1 ~ 8: 流脑、流感嗜血、肺炎克雷伯、金葡、军团、大肠、阴性对 照、无乳链; 9: 肺链40900; 10: 肺链52035; 11: 肺链62353; 12: 100bp 梯度分子量标记。 图 1 对8 种细菌进行lytA 基因的PCR 扩增 |
对161 株菌全部进行lytA 基因的PCR 扩增,另对流行性脑膜炎奈瑟菌、流感嗜血杆菌、 肺炎克雷伯杆菌、金黄色葡萄球菌、军团菌、大肠杆菌、无乳链球菌也同时扩增lytA 基因。
2.3 ply 基因的PCR 扩增(图 2)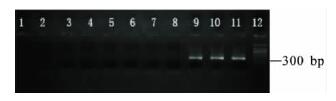 |
注: 1 ~ 8: 流脑、流感嗜血、肺炎克雷伯、金葡、军团、大肠、阴性对 照、无乳链; 9: 肺链40900; 10: 肺链52035; 11: 肺链62353; 12: 100bp 梯度分子量标记。 图 2 对8 种菌进行ply 基因的PCR 扩增 |
对161 株菌全部进行ply 基因的PCR 扩增,上述7 株菌也同时扩增ply 基因。
2.4 草链菌的鉴定试验和PCR 结果将15 株草绿色链球菌进行奥普托欣敏感性和胆汁溶解鉴定试验,结果显示,奥普托欣生长抑制区均< 16 mm,胆汁溶解试验均为阴性。15 株草链菌lytA 基因的扩增结果均为阴性,ply 基因的扩增中,仅有70 475、71 000 和41 387 菌株为阳性。
2.5 161 株菌的PCR 结果(表 1)| 表 1 lytA、ply 在肺链、草链中的分布情况 |
由146 株肺炎链球菌和 15 株草绿色链球菌的lytA、ply 基因的PCR 扩增结果显示,lytA基因的灵敏度为100% (146 /146) ,特异度为100% (15 / 15) ,阳性预测值为100% (146 /146) ,阴性预测值为100% (15 /15) 。ply 基因的灵敏度为100% (146 /146) ,特异度为 80%(12 /15) ,阳性预测值为98.0% (146 /149) ,阴性预测值为100%(12 /12) 。
3 讨 论众所周知,草绿色链球菌与肺炎链球菌在菌落形态上很相似,肉眼观察难以区分。因此,本研究将草链作为对照菌,探讨通过扩增lytA、ply 2 种基因的方法是否能将二者区分开。 本研究以161 株疑似肺炎链球菌的鉴定试验为金标准,由此得出,检测lytA 基因的灵敏度、特异度、阳性预测值和阴性预测值均为100%。有研究显示,通过扩增自溶素基因检测肺炎链球菌的灵敏度为92.8%,特异性为100%; 阳性和阴性预测值分别为100%和95%〔5〕。Carvalho〔6〕曾报道,在lytA、ply、 psaA(表面黏附素) 3 种基因中,lytA 基因的特异性最高,对来自于上呼吸道的样本特别是只能提取到微生物DNA 时,lytA 基因最适合于鉴定肺炎链球菌。扩增ply 基因时,15 株草链中有3 株是假阳性,表明,单独检测ply 基因,即使有的标本能扩增出该基因,实际上也可能不是肺炎链球菌感染。国外也有相同观点的报道,Messmer〔7〕认为用ply 基因鉴定肺炎链球菌并非特异性,如果只检测ply 一种基因可能会导致假阳性的错误。本研究在其他7 种常见呼吸系统病原菌中,均未检测到lytA、ply 基因。杨永红等〔8〕对20 株标准肺炎链球菌和7 株对照菌,通过扩增自溶素和溶血素基因后酶切的方法来检测肺炎链球菌,同样认为这2 套PCR 检测系统特异性强、灵敏度高。
本研究结果显示,检测lytA 基因的特异性高于ply 基因,表明lytA 基因比ply 基因更适用于检测肺炎链球菌。这一观点与Sourav〔9〕的研究结果有相同之处。可是,由于某些临床分离株的自溶素基因发生变异,导致其对胆汁溶解试验不敏感〔10〕,若只检测自溶素基因,此类菌株很可能被漏检。所以,在进行肺炎链球菌鉴定时,同时扩增自溶素基因和溶血素基因的2 套PCR 方案将更为可靠。
| 〔1〕 | 綦廷娜,王和,陈峥宏.肺炎链球菌L型对人淋巴细胞因子分泌刺激作用[J].中国公共卫生,2010,26(5):610-611. |
| 〔2〕 | Barzilay EJ,O'Brien KL,Kwok YS,et al.Could a single dose of pneumococcal conjugate vaccine in children be effective?Modeling the optimal age of vaccination[J].Vaccine,2006,24(7):904-913. |
| 〔3〕 | Kaijalainen T,Rintamki S,Herva E,et al.Evaluation of gene-technological and conventional methods in the identification of Streptococcus pneumoniae[J].J Microbiol Methods,2002,51(1):111-118. |
| 〔4〕 | Saukkoriipi A,Palmu A,Kilpi T,et al.Real-time quantitative PCR for the detection of Streptococcus pneumoniae in the middle ear fluid of children with acute otitis media[J].Mol Cell Probes,2002,16 (5):385-390. |
| 〔5〕 | Gillespie SH,Ullman C,Smith MD,et al.Detection of Streptococcus pneumoniae in sputum samples by PCR[J].J Clin Microbiol, 1994,32(5):1308-1311. |
| 〔6〕 | Carvalho Mda G,Tondella ML,McCaustland K,et al.Evaluation and improvement of real-time PCR assays targeting lytA,ply,and psaA genes for detection of pneumococcal DNA[J].J Clin Microbiol,2007,45(8):2460-2466. |
| 〔7〕 | Messmer TO,Sampson JS,Stinson A,et al.Comparison of four polymerase chain reaction assays for specificity in the identification of Streptococcus pneumoniae[J].Diagn Microbiol Infect Dis.2004,49 (4):249-254. |
| 〔8〕 | 杨永红,朱保权,宁淑敏,等.肺炎链球菌自溶素和溶血素基因的PCR法鉴定[J].微生物学免疫学进展,2000,28(2):49-53. |
| 〔9〕 | Sourav S,Patricia A,Sharma S,et al.Detection of pneumolysin and autolysin genes among antibiotic resistant Streptococcus pneumoniae in invasive infections[J].Indian J Med Microbiol,2010,28(1):34-39. |
| 〔10〕 | Díaz E,López R,García JL.Role of the major pneumococcal autolysin in the atypical response of a clinical isolate of Streptococcus pneumoniae[J].J Bacteriol,1992,174(17):5508-5515. |
 2011, Vol. 27
2011, Vol. 27



