随着人口老龄化,心力衰竭已成为当今世界威胁人类健康的主要疾病和心血管疾病防治最严峻的挑战之一〔1〕。近年来,通过干预心肌细胞Ca2+转运蛋白作为治疗靶点已成为慢性心力衰竭防治的重要内容〔2〕。在参与Ca2+ 转运的诸多结构中,钠-钙交换体(sodium-calcium exchanger,NCX) 就是一种重要的钙调节蛋白。NCX 主要参与3Na+与1Ca2+ 的反向跨膜转运,其分子结构中α 重复序列(包括α-1 和α-2) 是 NCX 发挥功能的关键肽段〔3, 4〕。研究发现,针对α-1 肽段的抗体可以增强心脏收缩〔5〕。然而,针对NCX α-2 肽段的抗体对心功能的影响报道较少。该抗体若能增强钠-钙交换和改善心功能,将有可能为防治心力衰竭新型药物研发和临床心力衰竭治疗提供实验依据。
1 材料与方法 1.1 实验动物选用健康Wistar 大鼠,雌雄不限,免疫用大鼠40 只,2 月龄(体重180 ~ 220 g) ,离体心脏灌流及膜片钳实验使用成年大鼠(体重240 ~ 260 g) (山西医科大学实验动物中心) ,许可证号: SCXK 晋2009-0001。
1.2 主要试剂与仪器生物素化山羊抗大鼠IgGs,辣根酶标记链霉卵白素(北京中山生物技术有限公司) ,完全福氏佐剂、不完全福氏佐剂、牛磺酸、哇巴因、尼卡地平、L-谷氨酸、乙二醇二乙醚二胺四乙酸(ethylene glycol tetraacetic acid,EGTA) (美国Sigma 公司) ; 胶原酶P (德国Bochringer Mannhein 公司) ; 4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl) -1- piperazineethanesulfonic acid,HEPES) (北京化学试剂厂) ; 其余试剂均为国产分析纯。酶标仪(美国Molecular Devices 公司) ; ML870B2 Langendorff 离体心脏灌流系统(澳大利亚AD Instruments 公司) ; Axopatch 200B 膜片钳放大器(美国Axon Instruments 公司) 。
1.3 抗原肽段合成钠-钙交换体α-2 重复序列肽段(第 807-820 位氨基酸残基,其序列为ALGTSVPDTFASKV,简称α-2(807-820) ) (西安美联生物科技有限公司) ,经高压液相色谱和质谱分析,合成肽纯度高于95%。
1.4 抗体制备及纯化参照文献〔6〕,将40 只大鼠随机分为2 组: 对照组(n = 15) 、免疫组(n = 25) 。免疫组利用人工合成的α-2(807-820) 与载体蛋白KLH(Pierce) 耦联后作为抗原免疫大鼠制备抗体,对照组除用等体积生理盐水溶液替代抗原溶液外,余同免疫组。用间接酶联免疫吸附(ELISA) 法检测抗体滴度,取高效价抗血清利用IgGs 亲和层析纯化试剂盒MAbTrap Kit(瑞典Amersham Pharmacia Biotech 公司) 对抗血清进行纯化,采用Bradford 蛋白定量法测定抗体的浓度。
1.5 心功能检测将大鼠腹腔注射戊巴比妥钠(50 mg/kg) 麻醉,迅速开胸取出心脏,经主动脉连至Langendorff 装置逆行恒压(120 mm Hg) 灌注,灌流液为95% O2+ 5% CO2 混合气体饱和的台氏液。台氏液成分(mmol/L) : NaCl 140,MgCl2 1.0,KCl 5.4,葡萄糖10,NaH2PO4 0.33,CaCl2 1.8,HEPES 5.0。将球囊测压管经左心耳通过二尖瓣口插入左心室,调节前负荷为10 mmHg 左右。利用Lab Chart6 生物信号采集处理系统记录左心室各项心功能指标,包括左心室发展压(left ventricular developed pressure,LVDP) 、左心室压最大上升速率(+ dp/dtmax ) 及最大下降速率(-dp/dtmax ) 等。
1.6 单个心室肌细胞分离大鼠麻醉后迅速取出心脏,悬挂于Langendorff 装置,用台氏液恒压灌流7 ~ 8 min,待流出液清亮后换为含有胶原酶P 100 mg/L、CaCl2 75μmol/L 以及牛磺酸20 mmol/L 的台氏液灌流10 ~ 15 min。待心肌组织酶解变软后,用眼科剪剪下置于Kraftbrühe(KB) 液中,用粗吸管轻轻吹打以分散心室肌细胞,室温保存至少4h 后备用。KB 液成分(mmol/L) : KOH 85,L-谷氨酸50,KCl 30,牛磺酸20,KH2PO4 30,MgCl2 1.0,HEPES 10,葡萄糖10,EGTA 0.5,用 KOH 调pH 至7.4。
1.7 全细胞膜片钳记录取1 ~ 2 滴细胞悬液加入倒置显微镜上的细胞池,静置2 ~ 3 min 后用含钙台氏液灌流复钙。将电极轻轻移动至细胞表面,施以负压使电极尖端和细胞膜之间产生高阻封接后,补偿电极电容,再以脉冲负压破膜,进行膜电容补偿和串联电阻补偿后,使用Axopatch 200B 膜片钳放大器和PCLAMP 9.0 程序记录膜电流。数据采用pClamp9.0 软件分析。钠-钙交换电流按Kimura 等描述的方法测定〔7〕。 在全细胞记录模式下,维持电压- 40 mV,斜坡电压脉冲从- 120 mV 以90 mV/s 的速率去极化至+ 60 mV。在细胞外液中加入尼卡地平1μmol/L,哇巴因20μmol/L,BaCl2 1.0 mmol/L (分别阻断钙通道、钠泵和内向整流钾通道) 的情况下,给予 5.0 mmol/L NiCl2 可以特异性地阻断钠- 钙交换电流,利用 Ni2+阻断前、后的电流差,即可得到Ni2+敏感的INa/Ca。
1.8 统计分析计量资料采用x± s 表示,使用SPSS 15.0 软件分析数据,多组间比较采用单因素方差分析,2 组间比较采用独立样本t 检验,P < 0.05 时,差异有统计学意义。
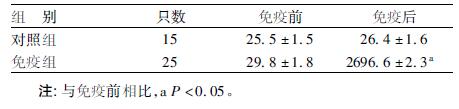
2 结 果 2.1 抗体滴度及纯化效果检测(表 1)| 表 1 主动免疫前、后大鼠血清抗体滴度变化(x±s,1: X) |
结果表明,在首次免疫前,对照组和免疫组的抗体滴度都较低,且2 组之间无明显差异,表明血清背景低,适合用于目的肽段免疫。在第3 次加强免疫1 周后,免疫组抗体滴度明显升高; 而对照组抗体平均滴度与免疫前相比无明显改变。亲和纯化后的抗血清在进行非变性聚丙烯酰胺凝胶电泳时仅有1 条带出现,分子量 160kDa 左右,与IgG 标准品相一致(图 1) 。用Bradford 蛋白质定量法测得纯化后抗α-2 抗体浓度为6.3 mg/mL。
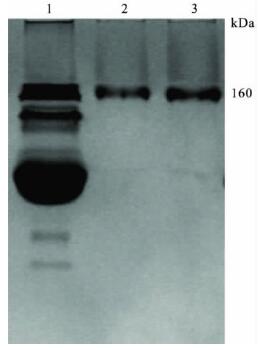 | 注: 1: 纯化前抗血清; 2: 纯化后抗体; 3: 标准品IgG。 图 1 抗α-2( 807-820) 抗体聚丙烯酰胺凝胶电泳检测 |
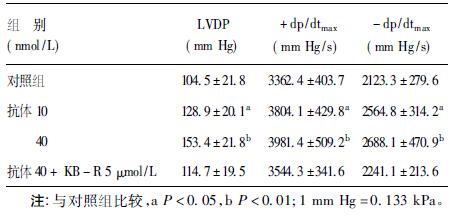
| 表 2 α-2( 807-820) 抗体对大鼠离体心脏心功能影响(x±s,n = 8) |
与对照组比较,抗α-2(807-820) 抗体在浓度为10 和40nmol/ L 时可明显升高LVDP、+ dp/dtmax和- dp/dtmax,表明抗钠- 钙交换体α-2(807-820) 抗体不仅增强心肌的收缩力和加快心肌收缩速度,而且可以促进心肌舒张。该抗体对心脏的上述效应可被NCX 特异性阻断剂KB-R7943 阻断。
2.3 钠-钙交换电流(INa/Ca ) 及α-2(807-820) 抗体影响(图 2)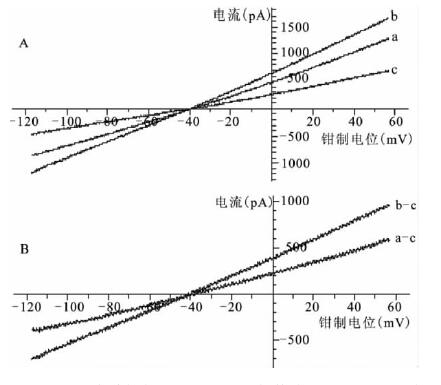 |
注: A: a,b 分别为给予α-2(807-820) 抗体前、后电压- 电流关系 曲线; c,加入5 mmol /L NiCl2 后电压- 电流关系曲线; B: 给予α- 2(807-820) 抗体前( a-c) 、后( b-c) 的Ni2+ 敏感钠-钙交换电流。 图 2 抗钠-钙交换体α-2( 807-820) 抗体对心肌细胞钠-钙交换电流影响 |
选取+ 50 mV 的外向电流和- 100 mV 的内向电流作为观测指标,待电流稳定后开始给药测定。结果表明,抗钠-钙交换体α-2(807-820) 抗体(40 nmol/L) 可使外向和内向钠-钙交换电流明显增大,外向和内向电流分别从给药前的(1.05 ± 0.17) 、(0.86 ± 0.21 ) pA/pF 增至给药后(1.53 ± 0.28 ) 、 (1.23 ± 0.31) pA/pF(t =-3.909,-2.603,P < 0.05) 。
3 讨 论钠-钙交换体α 重复序列(包括α-1 和α-2) 是NCX 发挥其Na+/Ca2+交换功能的关键肽段。本研究结果显示,α-2(807-820) 抗体可明显升高LVDP、+ dp/dtmax、- dp/dtmax,提示该抗体不仅可以增强心肌的收缩力和加快心肌收缩速度,还可加速心肌的舒张。此外,这一效应还可被KB-R7943 (NCX 特异性阻断剂) 阻断,可以推测,该抗体可能是通过激动心肌NCX 发挥作用。
Ca2+是触发心肌收缩和舒张的关键因子。作为心肌细胞钙稳态调节的一种重要机制,NCX 不仅通过反向模式(Na+外排,Ca2+内入) ,促进钙内流; 还可通过前向模式(Na+内入,Ca2+外排) ,促进舒张期钙外排。因此,若能增强NCX 的功能,将无疑会增强和改善心肌的舒缩功能〔8〕。大量研究表明,在心力衰竭等病理状态下,心肌细胞NCX mRNA、蛋白质表达水平及其功能均有不同程度的上调,而心肌肌浆网钙泵功能则表现为不同程度的下调〔9, 10〕。显然,心衰心肌NCX 的上调,对已降低的心功能具有一定的代偿意义。钠- 钙交换体α-2(807-820) 抗体通过激动NCX 可以同时增强心肌收缩和加速心肌舒张,这一特性将使其有可能成为临床治疗心力衰竭、改善心功能的一条新途径,并为防治心力衰竭新型药物的研发提供实验依据。
| 〔1〕 | 刘志勇,高长青,张卫红,等.冠状动脉旁路移植术后患者生存质量分析[J].中国公共卫生,2009,25(12):119-120. |
| 〔2〕 | Ikeda Y,Hoshijima M,Chien KR.Toward biologically targeted therapy of calcium cycling defects in heart failure[J].Physiology,2008, 23:6-16. |
| 〔3〕 | Iwamoto T,Uehara A,Nakamura TY,et al.Chimeric analysis of Na+/Ca2+ exchangers NCX1 and NCX3 reveals structural domains important for differential sensitivity to external Ni2+ or Li+[J].J Biol Chem,1999,274:23094-23102. |
| 〔4〕 | Ottolia M,Nicoll DA,Philipson KD.Mutational analysis of the α-1 repeat of the cardiac Na+/Ca2+ exchanger[J].J Biol Chem, 2005,280:1061-1069. |
| 〔5〕 | 白晓洁,封启龙,刘慧,等.NCXα1重复序列短肽主动免疫大鼠对心脏结构和功能的影响[J].中国免疫学杂志,2009,25 (4):303-305. |
| 〔6〕 | Feng QL,Fan GQ,Zhao JH,et al.Acquisition and purification of the antibody againstα-1 andα-2 repeats of Na+-Ca2+ exchanger[J].Journal of Shanxi Medical University,2005,36(4):395-398. |
| 〔7〕 | Kimura J,Miyamae S,Noma A.Identification of sodium-calcium exchange current in single ventricular cells of guinea-pig[J].J Physiol,1987,384:199-222. |
| 〔8〕 | Chandrasekaran S,Peterson RE,Mani SK,et al.Histone deacetylases facilitate sodium/calcium exchanger up-regulation in adult cardiomyocytes[J].FASEB J,2009,23:3851-3864. |
| 〔9〕 | Münch G,Rosport K,Baumgartner C,et al.Functional alterations after cardiac sodium-calcium exchanger overexpression in heart failure[J].Am J Physiol Heart Circ Physiol,2006,291:488-495. |
| 〔10〕 | Wei S,Ruknudin AM,Shou M,et al.Muscarinic modulation of the sodium-calcium exchanger in heart failure[J].Circulation,2007, 115:1225-1233. |
 2011, Vol. 27
2011, Vol. 27