有研究表明,低水平铅在发育早期可以明显抑制海马神经元神经细胞粘附分子(NCAM) 的表达,且可造成NCAM 表达时程的紊乱〔1〕。硒作为人体必需的微量元素,是谷胱甘肽过氧化酶的重要组成部分,参与机体的抗氧化防御作用,且硒有防止铅吸收和促进其排泄作用〔2〕。为了解硒拮抗铅神经毒性的效果及其相关机制并有效地利用硒,本研究探讨铅硒共同孵育对海马神经元生长及存活和神经细胞粘附分子蛋白表达的影响。现报告如下。
1 材料与方法 1.1 主要试剂与仪器解剖液、种植培养基、无血清培养基 〔由98%Neurobasal 培养基+ 2% B27(无血清培养基添加剂) + 1%的青链霉素组成〕(美国Invitrogen 公司) ; 胰酶、脱氧核糖核酸酶I(DNase I) 、台盼蓝、左旋硒蛋氨酸、四甲基偶氮噻唑蓝(MTT) 、抗NCAM 单克隆抗体、神经氨酸酶、抗β-微管蛋白单克隆抗体(美国Sigma 公司) ; 胎牛血清(杭州四季青生物材料研究所) ; 氯化铅(分析纯,广州化学试剂厂) ; 辣根过氧化物酶标记的蛋白印迹检测系统(英国Cell SignalingTecnology 公司) ; 蛋白酶和磷酸酶抑制剂鸡尾酒II(德国Merck 公司) 。CO2 细胞培养箱(美国Thermo 公司) ; 荧光倒置相差显微镜(日本Nikon 公司) ; 垂直电泳及转移系统(美国Bio- Rad 公司) 。
1.2 方法 1.2.1 海马神经细胞的分散、种植和培养参照文献〔3〕。
1.2.2 细胞分组及染毒将细胞随机分为6 组,即氯化铅组 (对照组) 、氯化铅+ 低、次低、中、次高、高剂量硒蛋氨酸组 (0.125、0.25、0.5、1.0、2.0 μmol /L) 。分别加入预先配好浓度的氯化铅、硒蛋氨酸各20 μL,使各孔中氯化铅终浓度为10 μmol /L,使各孔中硒蛋氨酸终浓度分别为0.125、0.25、0.5、 1.0、2.a0 μmol /L。每次换液时,补入相应量的氯化铅和硒蛋氨酸,维持其终浓度不变。
1.2.3 神经元存活率测定将分离的细胞接种植至96 孔板中,分别染毒培养至终点后,每孔加入MTT 溶液(5 mg /mL) 20 μL,37 ℃继续孵育4 h 后,每孔加100 μL 细胞裂解液,振荡10 min,使结晶物充分溶解,在超净工作台放置2h 后在酶联免疫检测仪上测A 值,记录结果,算出细胞的存活率。
1.2.4 神经元轴突长度测定在荧光倒置相差显微镜下(× 200) ,各观察时间点对各剂量组随机选择20 个视野进行拍照,并利用Image pro-plus 软件测量形态可辨的60 个神经元轴突长度,取其平均值进行比较。
1.2.5 NCAM 表达测定(1) 总蛋白提取及定量: 取待测的培养神经元,吸弃培养基,用冷磷酸盐缓冲溶液洗2 次,每孔中加入70 μL 细胞裂解缓冲液,收集细胞,冰浴中静置30 min,超声破碎(3 watt,15 s) ,立即40 ℃离心20 min(14 000 r/min) ,收集上清,-20 ℃保存。采用Bradford 检测法〔4〕对上述提取的蛋白进行定量。(2) 免疫印迹: 灌制7% 分离胶和 5%浓缩胶; 每个样本分别取18 μg 总蛋白与上样缓冲液混合后,于99.90 ℃沸水中加热5 min,使之充分变性; 电泳; 250 mA 转膜4 h; 室温下封闭2h; 一抗(抗NCAM,抗β-微管蛋白) 孵育,40 ℃过夜; 次日与二抗室温下共同孵育1h; 发光显影,定影,冲洗,晾干。
1.2.6 图像分析扫描仪扫描后,用Scion Image 软件测定β-微管蛋白、NCAM140、NCAM180 和NCAM 条带平均灰度值并分别计算出NCAM140、NCAM180、NCAM 与β-微管蛋白的平均灰度比值。
1.3 统计分析应用SPSS 11.0 软件进行方差分析。
2 结 果 2.1 铅硒共同孵育对原代培养海马神经元形态影响神经元种植24 h 后,与氯化铅组比较,铅硒共同孵育组的贴壁细胞数增多; 更换培养基后,终浓度为氯化铅+次高剂量硒蛋氨酸组的细胞密度最多,背景清晰; 3 d 后,铅硒共同孵育组培养板中小体积圆形透亮细胞较氯化铅组少,胞体体积较大、饱满,胞浆丰富,培养的神经元出芽明显早于氯化铅组,轴突明显增长; 5 d 后,铅硒共同孵育组的神经元轴突联结成网更加密集; 铅硒共同孵育组在观察时间内悬浮细胞和死亡细胞的碎片均较氯化铅组少,且背景清晰,其中氯化铅+次高剂量硒蛋氨酸组的细胞碎片最少。
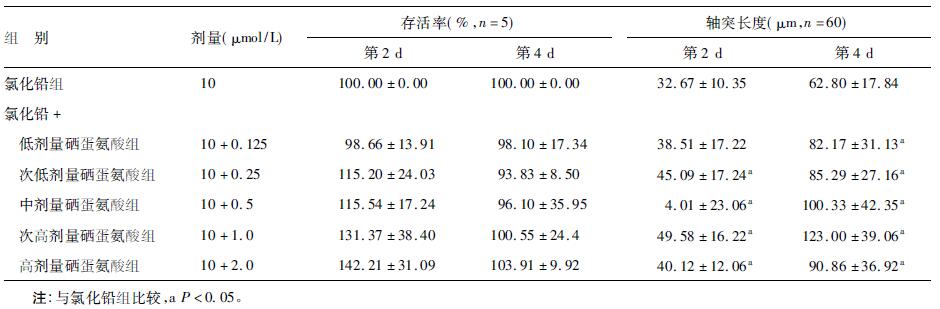
2.2 铅硒共同孵育对海马神经元存活率与轴突长度影响 (表 1)| 表 1 铅硒共同孵育对神经元存活率和轴突长度影响(x±s) |
在同一处理时间,随着硒蛋氨酸浓度的升高,铅硒共同孵育组的细胞存活率也随之增加,但与氯化铅组比较差异无统计学意义(P > 0.05) ; 随着孵育时间的延长,各处理组海马神经元存活率也随之下降,但氯化铅+ 次高剂量硒蛋氨酸组和氯化铅+高剂量硒蛋氨酸组的海马神经元存活率仍略高于氯化铅组。
培养第2 d,即出现铅硒共同孵育组中神经元轴突长度比氯化铅组增长约6 ~ 17μm,差异有统计学意义(P < 0.05) ,且在同一处理时间内,铅+ 次高剂量的硒蛋氨酸组海马神经元轴突长度最长; 随着海马神经元培养时间的延长,其轴突的长度也随之增加。
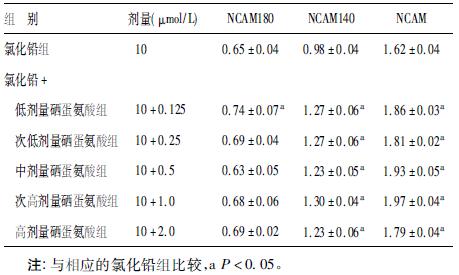
2.4 铅硒共同孵育对海马神经元NCAM 表达水平影响(表 2)| 表 2 铅硒共同孵育对NCAM表达影响的平均灰度比值(x±s) |
NCAM 主要有3 种亚型,分别为NCAM120、NCAM140 和 NCAM180。从表 2 中可以看出,不同剂量铅硒共同孵育组的海马神经元NCAM 表达量均高于氯化铅组,其中氯化铅+ 中剂量硒蛋氨酸组的NCAM 表达量最高; 在各处理组中,NCAM140 表达量均明显高于NCAM180,可能与神经氨酸酶的作用条件有关。
3 讨 论NCAM 作为免疫球蛋白超家族成员之一,在神经系统发育中具有重要作用。NCAM 除了参与同源性和异源性细胞间相互作用外,也能够通过胞内信号转导、翻译后修饰和细胞膜表达水平改变机制来调节活性依赖突触重排〔5〕。本研究发现,各剂量铅硒共同孵育组与氯化铅组在神经元的轴突长度上差异有统计学意义,提示硒对铅抑制神经元的突起生长具有一定拮抗作用。进一步研究表明,不同剂量的铅硒共同孵育组海马神经元NCAM 的表达量均高于氯化铅组,其中氯化铅+ 次高剂量硒蛋氨酸组NCAM 表达量最高,提示硒可增加NCAM 的表达量,可在一定程度上拮抗铅所致的神经毒作用。
本研究结果表明,铅硒共同孵育组海马神经元存活率与氯化铅组比较,差异无统计学意义,与文献〔6〕报道一致。 Hideaki Sakai 等〔7〕研究发现,细胞间粘附是成骨细胞存活的必要条件,因为成骨细胞间粘附的缺失可促进成骨细胞的凋亡,它可能是线粒体通透性转换和caspase 激活共同参与凋亡过程的结果。本研究结果是否由于铅与硒形成铅-硒复合物,增加细胞间距离,降低细胞间的粘附,导致海马神经元存活率下降,有待进一步研究证实。
| 〔1〕 | 胡前胜,任铁玲,傅洪军,等.低剂量铅对海马神经元神经细胞黏附分子表达的影响[J].中华预防医学,2004,38(6):379-382. |
| 〔2〕 | 李敏,高俊全,李筱薇.硒对铅毒性的拮抗作用[J].卫生研究, 2005,34(3):375-377. |
| 〔3〕 | 胡前胜,董胜璋,陈学敏,等.低剂量铅对原代培养的海马神经元的影响[J].中国公共卫生,2003,19(5):518-520. |
| 〔4〕 | 汪家政,范明,主编.蛋白质技术手册[M].北京:科学技术出版社,2001:47-51. |
| 〔5〕 | Venero C,Herrero AI,Touyarot K,et al.Hippocampal up-regulation of NCAM expression and polysialylation plays a key role on spatial memory[J].EUR J NEUROSCI,2006,23:1585-1595. |
| 〔6〕 | 王淑玉,任铁玲,张悦,等.铅硒联合作用对原代培养海马神经元影响[J].中国公共卫生,2007,23(1):73-74. |
| 〔7〕 | Sakai H,Kobayashi Y,Sakai E,et al.Cell adhesion is a prerequisite for osteoclast survival[J].Biochem and Biophys Res Commun, 2000,270:550-556. |
 2011, Vol. 27
2011, Vol. 27