2. 郑州大学基础医学院微生物与免疫教研室;
3. 郑州大学基础医学院病理与病生教研室
DNA 聚合酶B(DNA polymerase beta,pol β) 是参与碱基切除修复(BER)以及跨损伤修复,对受损或突变基因起修复作用的人体修复酶之一〔1, 2〕。研究发现,食管癌组织中存在着发生于癌变早期的pol β基因突变和pol β基因mRNA 的高表达〔3〕,提示食管癌的发生发展可能与pol β基因过表达和突变有关。本研究前期发现,人食管癌组织pol β基因启动子碱基序列存在不同形式突变且许多突变位点可引起其启动子转录活性的改变〔4〕。因此,本实验通过检测食管癌细胞EC-1 中DNA pol β启动子的突变,探讨EC-1细胞pol β启动子突变位点及形式对其启动子转录活性的影响,并通过重组质粒转染不同的细胞探讨食管肿瘤细胞中是否存在促进pol β启动子活性增加的作用因素,为深入研究pol β基因启动子在癌症的发生发展中的作用和靶向基因治疗提供实验依据。现将结果报告如下。
1 材料与方法 1.1 材料(1)细胞株: 食管癌细胞株EC-1 (郑州大学基础医学院微生物与免疫教研室冻存),食管癌细胞株Eca9706 (郑州大学基础医学院病理生理教研室保存),正常永生化细胞293T (中国典型培养物保藏中心,CCTCC) ; (2) 菌株与质粒: 大肠埃希菌DH5A菌株(郑州大学基础医学院微生物与免疫教研室冻存),pGL3-neo-enhancer质粒( 本课题组前期改建),pGEM-T 克隆质粒和pGL3-enhancer载体(美国Promega 公司); (3)试剂: 萤光素酶试剂盒E1500、Taq DNA 聚合酶、 T4DNA连接酶和4×dNTP(美国Promega公司); Lipof Ectamine TM 2000转染试剂盒(美国Invitrogen 公司),质粒小量提取试剂盒和胶回收试剂盒(美国AXYGEN 公司),RPM I1640、胎牛血清(FBS) (杭州四季青公司)。
1.2 方法 1.2.1 引物设计参照GenBank和pol β基因启动子序列文献〔5〕,设计扩增pol β 基因启动子序列引物: 上游P1 5'- AAAGGATTCCAGATAAACAC-3',下游P2 5'-GCTGGAAGGAAAGAAGAAAG- 3',产物大小499 bp; 扩增pol β启动子核心区引物: 上游PGL1 5'-GCACTCGAGAAAGGATTCCAGATAAACACTG- 3',下游PGL2 5'-TATAAGCTTGGCGGCCTGCACCCGAGAACCC- 3',上游引物引入Xho I酶切位点,下游引物引入Hind III酶切位点,产物大小392 bp。引物由上海生工公司合成。
1.2.2 基因组DNA提取及pol β启动子DNA 序列扩增参照AXYGEN质粒小量提取试剂盒操作规程分别提取EC-1和 293T 细胞基因组DNA 并纯化。用P1和P2引物,PCR扩增 pol β启动子序列。扩增条件: 94℃预变性5 min,94℃变性 30s,57℃退火30 s,72℃延伸40 s,循环25次,最后72℃延伸5 min,4℃保存。取扩增产物5 μL,用琼脂糖凝胶电泳,溴化乙锭( EB)双染色,256 nm 紫外灯下观察结果。
1.2.3 目的片段克隆及测序用DNA 胶回收试剂盒对PCR 产物进行纯化后再次用电泳鉴定。鉴定正确后,将纯化所得目的片段与pGEM-T 4℃连接过夜,转化感受态细菌DH 5A,接种含异丙基-B-D-硫代半乳糖苷(IPTG) 和5-溴-4-氯-3-吲哚- B-D-半乳糖苷(X-gal)的含氨苄青霉素( Amp + )的Luria-Bertani( LB)培养基平板培养。取半个白色菌落留种,另半个溶于20 μL水中,100℃水浴裂解细菌后,用通用引物T7/SP6 进行PCR,以鉴定目的片段是否转入。鉴定正确后用接种环取留种的阳性克隆细菌接种到LB液体培养基中,37℃摇床培养过夜,次日将菌液装入Eppendo rf( EP) 管中封好准备测序,测序由上海生工生物公司完成。测得序列利用DNA 序列分析软件DNASIS、OM IGA与GenBank中查到的DNA pol β启动子序列进行同源性比较和分析,确定突变位点和形式。
1.2.4 含野生型/突变型pol β启动子的萤光素酶报告基因重组质粒构建及鉴定将测序正确的阳性克隆( 野生型和突变型) 用Xho I和Hind III双酶切,回收的目的片段克隆至经同样酶切处理的pGL3-neo-enhancer中,得到重组质粒pGL3-neo-293T-pol β /promoter(野生型)和pGL3-neo-EC-1-pol β /promoter(突变型),转化感受态DH-5A,氨苄青霉素阳性培养板筛选,聚合酶链式反应(PCR),双酶切和正反双向测序鉴定所构建的野生型和突变型重组质粒的正确性,并确认突变位点正确存在且在392 bp范围之内。
1.2.5 细胞培养及质粒转染用含100 ml /L的小牛血清 RPM I( Roswell Park Memorial Institute) 1640培养基培养EC-1、 Eca9706和293T 细胞; 将构建的野生型和含-137位和-166 位G→ A 突变的突变型重组质粒,用脂质体Lipo fectamine 2000分别转染EC-1、E ca9706和293T 细胞,按试剂盒使用说明操作,然后用终浓度为600 Lg /mL G418培养液筛选阳性细胞克隆和200 Lg /mL G418扩大培养细胞待测。
1.2.6 萤光素酶活性检测实验分空白细胞组(未转染任何质粒的EC-1、E ca9706 和293T 细胞)、对照组( 转染pGL3- neo-enhancer空载体)、野生组( 转染含野生型pol β 启动子的萤光素酶报告基因重组质粒pGL3-neo-293T-pol β /promoter)、 突变组(转染含- 137和- 166位G→ A 突变的pol β启动子萤光素酶报告基因重组质粒pGL3-neo-EC-1-pol β/ promoter)。 将上述细胞以每孔1×106 个细胞接种于24孔板中,每组设6 个复孔,按照试剂盒说明,使用Glo Max20/20型萤光素酶萤光检测仪进行萤光素酶活性测定。每组实验至少重复3 次,取平均值。
1.3 统计分析萤光素酶活性检测数据用x±s表示,采用 SPSS 14.0软件进行单因素方差分析。以P < 0.05为差异有统计学意义。
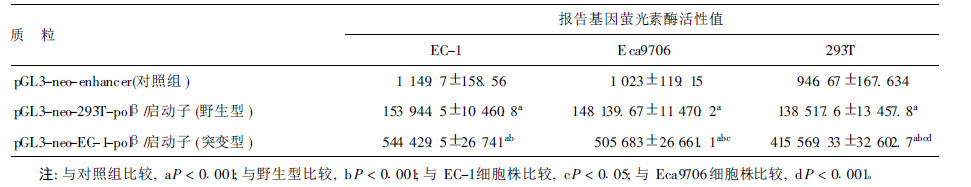
2 结果 2.1 PCR 扩增含pol β启动子DNA序列及pol β启动子突变筛选(图 1)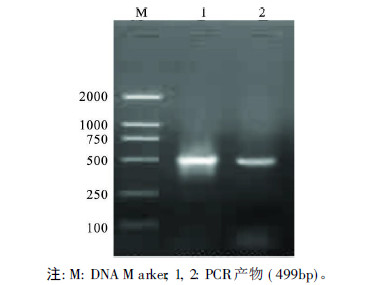 | 图 1 pol β启动子DNA 序列扩增产物 |
分别以提取EC-1和293T 细胞基因组DNA 为模板,PCR扩增EC-1 和293T 细胞pol β 启动子区序列。499 bp处有一条带,为目的基因片段。根据PCR 扩增产物正反双向测序及同源性比较结果,293T 细胞pol β启动子序列与Gen-Bank和文献报道〔5〕一致者确定为野生型,EC-1细胞pol β启动子含-137位和-166位G→ A突变者确定为突变型。
2.2 野生型和突变型萤光素酶重组质粒构建与鉴定(图 2,3)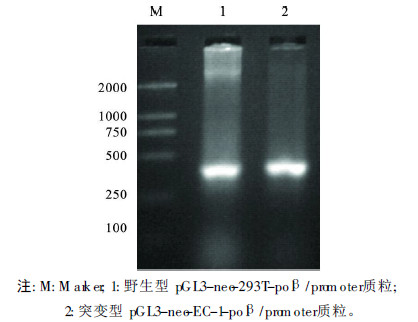 | 图 2 野生型和突变型的pGL3 pol β/promoter质粒凝胶电泳结果 |
 | 图 3 萤光素酶重组质粒( PGL3-neo-pol β/promoter)双酶切鉴定结果 |
将野生和突变的pol β 基因启动子序列分别插入萤光素酶报告载体的多克隆位点。以PGL1,PGL2 为引物进行PCR 扩增,图 2可见,其产物在392 bp处可见电泳条带,与目的基因片段一致。从上述PCR 鉴定为阳性的重组子菌落中提取质粒,用Xho Ⅰ和HindⅡ 双酶切筛选阳性克隆,图 3可见,同样在392 bp处可见电泳条带。DNA 正反双向测序鉴定结果显示,插入的野生型序列正确,突变型的突变位点正确不变,表明pGL3-neo-293T-pol β /promo ter 和pGL3-neo-EC-1-pol β /promoter载体构建成功。
2.3 萤光素酶活性比较(表 1)| 表 1 不同质粒转染相同细胞后的萤光素酶活性值( x±s) |
空白细胞组萤光素酶活性值为( 1 000±50); 3种不同质粒分别转染入EC-1或Eca9706 或293T 细胞后,野生型和突变型与对照组,野生型与突变型的差异均有统计学意义( P < 0.001) ; 对照组和野生型质粒在不同细胞株中的萤光素酶活性值差异无统计学意义(均P > 0.05),突变型质粒在不同细胞株中的萤光素酶活性值差异有统计学意义。
3 讨 论研究表明,DNA 聚合酶β( pol β) 具有跨损伤合成的功能,同时还参与DNA 复制,由于pol β无3'→5c的校读功能,在 DNA合成中复制保真度最低。pol β还可参与更为广泛的细胞生命活动,如基因组DNA 重组、以及与癌细胞对某些药物的抗药性〔6, 7, 8〕。在结肠癌、胃癌、膀胱癌、食管癌等多种人类肿瘤组织中,已发现pol β 的基因突变和/或表达异常〔3, 9, 10〕。 本实验结果显示,食管癌细胞株EC- 1的pol β基因启动子存在- 137位和- 166位G→ A 位点突变,并且本试验构建成功的pol β启动子野生型及突变型重组质粒在EC-1、Eca9706或 293T 细胞3种细胞中均具有较强的启动转录活性,相同细胞株中,突变型的萤光素酶活性值高于野生型,提示EC-1食管癌细胞的pol β基因启动子- 137位和- 166 位G→ A突变位点及突变形式可使萤光素酶转录活性上调,与本研究前期研究结果一致〔4〕。
由于细胞株来源和性质不同,细胞内微环境可能存在一定差异。本试验结果显示,,含突变型pol β启动子的萤光素酶重组质粒在EC-1 及Eca9706 中活性高于293T细胞,提示 EC-1及Eca9706肿瘤细胞中可能存在使突变型pol β启动子活性增加的作用因子; 2种食管癌细胞株比较,含突变型pol β 启动子的萤光素酶重组质粒在食管癌低分化细胞株EC-1中萤光素酶活性值比高分化细胞株Eca9706 中高,表明食管癌的低分化和高分化细胞株的微环境也有一定差异。本实验构建的突变型pol β启动子源自低分化食管癌EC-1细胞,因此,当含突变型pol β启动子的萤光素酶重组质粒转入此细胞株时可能更具有特异性。
以上结果提示,食管癌低分化细胞株EC-1中pol β 基因启动子存在的突变可能上调靶基因pol β表达,且食管癌细胞中存在的使DNA pol β启动子活性增加的作用因子均可能是导致pol β高表达的因素。该结果可为肿瘤的靶向基因治疗提供新的思路。
| 〔1〕 | Gembka A,Toueille M,Smirnova E,et al. The checkpoint clap,Rad9-Rad1-Hus1 complex,preferentially stmiulates the activity of apurinic/apyrmi idinicendonuclease 1 and DNA polymerase beta in long patch base excision repair[J].Nucleic Acids Res,2007,35(8):2596-2608. |
| 〔2〕 | Sykora P,Snow ET.Modulation of DNA polymerase beta-dependent base excision repair in cultured human cells after low dose exposure to arsenite[J].Toxicol Appl Phamracol,2008,228(3):385-394. |
| 〔3〕 | 赵国强,王涛,赵明耀,等.食管正常、癌前及癌变组织中DNA聚合酶BmRNA检测[J].郑州大学学报:医学版,2005,40 (4):603-605. |
| 〔4〕 | 李月白,于雅丽,赵国强,等.DNA聚合酶B基因启动子在食管癌组织中的突变分析[J].世界华人消化杂志,2008,16(23):2649-2652. |
| 〔5〕 | Guo Z,Zheng L,Dai H,et al.Human DNA polymerase beta polymorphism,Arg137 Gln,mipairs its polymerase activity and interaction with PCNA and the cellular base excision repair capacity[J].Nucleic Acids Res,2009,37(10):3431-3441 |
| 〔6〕 | 赵军,路静,杨洪艳,等.DNA 聚合酶 B基因表达对NIH3T3 细胞增殖影响[J].中国公共卫生,2010,26(1):106-108 |
| 〔7〕 | Day K,Shefer G,Richardson JB,et a1.Nestin-GFP reporter expression defines the quiescent state of skeletal muscle satellite cells[J].Dev Biol,2007,304 (1):246-259. |
| 〔8〕 | Zhang Y,Pan D,Sun X,et a1.Production of porcine cloned transgenic embryos expressing green fluorescent protein by somatic cell nuclear transfer[J].Sci China CLife Sci,2006,49 (2):164-171. |
| 〔9〕 | Benjam in D,Colombi M,Stoecklin G,et a1.AGFP-based assay for monitoring post-transcriptional regulation of ARE-mRNA turn over[J].Mol Biosyst,2006,2 (11):561-567. |
| 〔10〕 | Itakura E,Odaira K,Yokoyama K,et a1.Generation of transgenic rats expressing green fluorescent protein in S-100beta-producing pituitary folliculo-stel late cells and brain astrocytes[J].Endocrinology,2007,148(4):1518-1523. |
 2011, Vol. 27
2011, Vol. 27