苯胺、苯酚作为重要的化工原料广泛应用于制药、塑料和油漆等行业,相应地在生产过程中也带来了潜在的环境安全问题。苯胺是一种致癌物质,对人体和环境危害极大,是重要检测指标〔1, 2, 3〕。苯酚对人体也具有致癌、致突变的潜在毒性,可抑制中枢神经或损害肝、肾功能〔4〕。在实际检测中,采用分光光度法检测苯胺和苯酚时两者的吸收光谱互相干扰〔5, 6〕,不能直接测定。本研宄采用自制正相硅胶整体柱进行苯胺、苯酚快速分离,利用分光光度法分别测定其含量,获得了较好效果。
1 材料与方法 1.1 主要仪器与试剂Beckman DU530紫外分光光度计,KL-009袖珍数显酸度计,YPZ202N电子天平。四甲基硅烷 (纯度≥98% ),聚乙二醇10 000(生化级纯度≥99% ),甲酰胺(纯度98. 5% ),苯胺标准品(纯度98% )(百灵威公司); 2.0g/L苯胺标准储备液;10mg/L苯胺标准使用液;2%邻甲氧基苯酚乙醇液;50 g/L NaNO2溶液;25 g/L NH4SO3NH2溶液: 3mol/L NaOH溶液;苯酚标准品(纯度99%),1g/L苯酚标准储备液;0.01 g/L苯酚标准使用液;pH 9.4硼酸-氯化钾-氢氧化钠缓冲液;0.5% 2,6-二溴苯醌-4-氯亚胺乙醇液。
1.2 试验方法 1.2.1 苯胺、苯酚的分离以四甲氧基硅烷、水溶性的聚乙二醇为原料,甲酰胺为化学干燥控制剂获得稳定的硅胶整体柱。以此作为色谱固定相,以正己烷/异丙醇=99/1(V/V)作为流动相,流速为0.8 mL/min对50ng/L的苯胺、苯酚混合液进行分离,分别收集2种组分。
1.2.2 苯胺的测定取10mL苯胺标准使用液于25mL具塞比色管中,加入0.05 mL 50 g/L NaNO2溶液,摇匀放置5 min加入25 g/L NH4SO3NH2溶液0. 5 mL,充分振荡至气泡消失。加入2%邻甲氧基苯酚0.5 mL摇匀后加入3 mol/L NaOH溶液0. 5mL,定容至25mL,在450 nm处测量吸光值。
1.2.3 苯酚的测定取10mL苯酚标准使用液于25mL具塞比色管中,加入1 mL pH 9.4硼酸-氯化钾-氢氧化钠缓冲液混匀,加入0. 5% 2,6-二溴苯醌-4-氯亚胺乙醇液0.2 mL摇匀放置20 min在600 nm处测量吸光值。
2 讨论与结果 2.1 苯胺、苯酚的分离(图 1)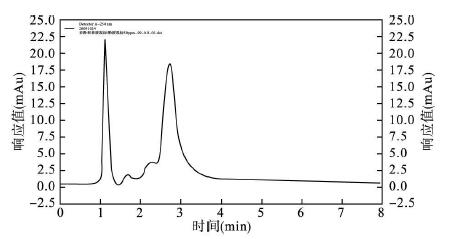 | 图 1 苯胺、苯酚的色谱分离谱图 |
以四甲氧基硅烷、水溶性的聚乙二醇为原料,甲酰胺为化学干燥控制剂获得稳定的硅胶整体柱。以此为色谱柱,在优化的条件下即正己烷异丙醇= 99/1(V/V)作为流动相,流速为0. 8mL/min可将苯胺、苯酚混合液在3min内有效分离(第1个苯酚,第2个苯胺)。此方法有效地改善了常规色谱法分离费时的缺点。
2.2 苯胺测定 2.2.1 吸收光谱本方法利用亚硝酸钠在酸性条件把苯胺氧化为重氮化合物,以邻甲氧基苯酚作为显色剂,在碱性条件与偶氮化合物反应生成黄色化合物,用紫外分光光度计对所得显色液进行扫描,可知邻甲氧基苯酚与苯胺形成的偶氮化合物在450 nm处有最大吸收。
2.2.2 显色剂用量的确定取1mL苯胺使用液稀释至10 mL加入 0.05 mL NaNO2反应 5min后,加入 0.5 mL NH4SO3NH2溶液,振荡至无气泡产生,分别加入0.5、0.8、 1.0、1.2 mL 2%邻甲氧基苯酚,加入0.5mL NaOH溶液在450nm测量吸光度值,最终确定0. 5mL邻甲氧基苯酚显色效果 最佳。
2.2.3 重氮化反应时间的影响在其他实验条件不变的情况下,调整重氮化反应时间分别为1、3、5、7、9 min测量其吸光度值,实验结果证实5min为重氮化反应最佳时间。
2.2.4 阳对显色反应的影响在反应中加入不同量NaOH调节溶液pH分别至8. 62、9. 00 、9. 99 、10. 91、11. 90。实验结果表明pH为10时,苯胺显色完全,即在25mL中加入0. 5 mL 3 mol/L NaOH可保证溶液完全显色。
2.2.5 显色时间及稳定性实验结果表明,在室温下显色反应均瞬时完成,且偶氮化合物稳定>24 h。
2.2.6 共存离子影响实验对此方法进行了干扰测定,测定内容为常见的金属干扰离子和有机物。在苯胺浓度为 1mg/L时,相对误差控制在±5%时,2x105倍量Na+、K + ,5x104倍量甲醇、乙醇,2x104倍量甲苯,800倍量Ca2+等均不干扰测定。400倍量Mg2+离子、2 000倍量丙酮的相对误差达±10%左右。其他金属离子需要加入掩蔽剂或事先分离再进行测定。
2.2.7 标准曲线与精密度测定在优化的条件下绘制标准曲线,结果如下:A= 0.232 9C + 0.0131(r2= 0.9997)式中,A 为吸光度;C为苯胺的浓度(mg/L)。在0~ 8mg/L范围内均可获得线性很好的标准曲线。同时通过对试剂空白进行11次实验测定工作曲线的精密度,标准偏差为0.000786,按照 3δ/S方法计算出检出限为0.010mg/L。
2.2.8 实际水样分析采用此方法对天津市海河和自来水水样进行分析。海河水样需过滤,苯胺测定结果可知,2种水样均未检测到苯胺。通过加标回收测得此方法回收率分别为 12.4%、12.5%。
2.3 苯酚的测定 2.3.1 吸收光谱本实验方法是利用苯酚在碱性条件下与 2,6-二溴苯醌-4氯亚胺反应生成蓝色缩合物测定进行。用紫外分光光度计对所得显色液进行扫描,可知2,6-二溴苯醌-4-氯亚胺与苯酚形成的显色化合物在600 nm处有最大吸收峰。
2.3.2 显色剂用量的确定实验时,在1mL苯酚使用液中分别加入0.05% 2,6-二溴苯醌-4-氯亚胺0. 0、0. 1、0. 2 0.3、0.4、0.5、0.6 、0.7、0.8mL显色后在 600 nm处测量吸光 度值,发现在0.4mL后吸光度值变化不大。在实际测量中加入0.2mL的0.5%的2,6-二溴苯醌-4-氯亚胺作为显色 剂。
2.3.3 显色时间的确定显色后分别在5、10、15、20 、25、30、 35、40 、45、50min进行测量,实验结果表明在25min后,显色物的吸光度变化较小,因此显色后放置25min测量最佳。
2.3.4 共存离子影响通过在试样中添加常见的金属干扰离子和有机物,本实验对此方法进行了干扰测定。在苯酚浓度为2mg/L时,相对误差控制在10%时,1X105倍量Na+、 K+,5x 104倍量甲醇、乙醇,10倍量苯胺等均不干扰测定。对于其他金属离子需要加入掩蔽剂或事先分离再进行测定。
2.3.5 标准曲线与精密度测定在优化的条件下绘制标准曲线如图 2所示,结果如下: A = 0. 103 9C- 0.068 5(r2 = 0.998 0)式中,A为吸光度,C为苯酚的浓度(mg/L)。在 0~8mg/L范围内可获得线性很好的标准曲线。同时通过对试剂空白进行11次实验测定工作曲线的精密度,标准偏差为 0.000 522按照3δ/S方法计算出检出限为0.015mg/L。
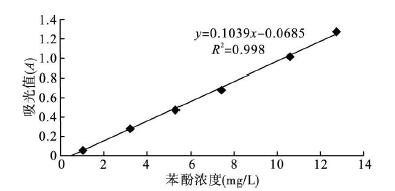 | 图 2 苯酚的标准曲线 |
用此方法对自来水水样进行分析。实验结果表明水样不含有苯酚。通过加标回收实验,测得其回收率为10.8%。
3 小 结本实验利用硅胶整体柱和分光光度法实现了对水中苯酚、苯胺的快速分离和测定。此方法较好地解决了两者直接测量时光谱互相干扰的问题。方法中苯胺的检测限为0.010 mg/L线性范围为0~ 8mg/L苯酚的检测限为0.015mg/L线性范围为0~ 8mg/L。方法用于环境水样中苯酚、苯胺的测定,回收率分别为10.8%、12.45%。
| 〔1〕 | 武秀红,梁丽娜,董存智.水中苯胺重氮化偶联反应共振光散射法测定 [J].中国公共卫生,2008,24(5):1406-1407. |
| 〔2〕 | 杨晓芬,赵美萍,李元宗,等.水中苯胺类化合物的分光光度法测定 [J].分析化学,2002,30(5):540-543. |
| 〔3〕 | 国家环境保护总局.水和废水监测分析方法 [M].4版.北京:中国环境科学出版社,2002:465-467. |
| 〔4〕 | 张丽萍,王蓉,李伟辉,等.废水中苯酚的测定方法研究 [J].现代仪器,2006,12(6):60-65. |
| 〔5〕 | 吴咏梅.卡尔曼滤波分光光度法同时测定炼油废水中苯酚和苯胺的研究 [J].光谱实验室,2004,21(2):258-260. |
| 〔6〕 | 写文彬,俞凌云,张新申.苯酚的测定方法及其研究进展 [J].西部皮革,2009,31(2):10-15. |
 2011, Vol. 27
2011, Vol. 27


