线粒体是细胞进行有氧代谢的场所,在各种致病因素作用下线粒体极易出现各种结构和功能损伤[1]。线粒体DNA ( mitochondrical DNA,mtDNA ) 是惟一存在细胞核以外的遗传物质,是线粒体蛋白质合成所必需[2]。mtDNA 极易受到活性氧的攻击,而产生氧化性损伤[3]。前期研究发现,姜黄素对 HT-29细胞的m tDNA 和核DNA ( nDNA )损伤均呈剂量依赖关系,并且对m tDNA 的损伤作用明显大于nDNA[4],表明 mtDNA损伤可能是导致细胞功能改变的根源。为探讨mtDNA 缺失和线粒体功能缺失对核基因表达的影响,本研究采用人全基因组芯片分析m tDNA 缺失HepG2细胞和线粒体功能缺失H epG2细胞中nDNA 的表达情况。现将结果报告如下。
1 材料与方法 1.1 主要试剂与仪器羰基氰4-(三氟甲氧基)苯腙、溴化乙锭( EB) (美国Sigm a 公司); TR Izol 试剂、胎牛血清( 美国 GIBCO 公司); 芯片杂交试剂盒、表达谱基因芯片(上海康成生物公司)。CO2 培养箱(美国FORMA 公司)。
1.2 细胞人肝癌细胞H epG2( 中国协和医科大学,ATCC H B28065)。采用含双抗( 100 U /mL青霉素,100 μg /mL链霉素) 及10%胎牛血清的含非必需氨基酸的最低限度的基本培养基(M EMNEAA),在37 ℃ 、5% CO2 的培养箱中培养细胞,取处于指数生长期的细胞用于实验。
1.3 细胞处理 1.3.1 m tDNA 缺失的H epG2 细胞制备参考文献[5],H epG2细胞连续暴露于添加EB ( 50 ng /mL) 、丙酮酸盐( 100μ g /mL)和尿苷( 50 μg /mL) 的培养基中,经过7代培养后,其 m tDNA几乎完全缺失,PCR 测定m tDNA 的含量< 5% 时,进行克隆培养即为m tDNA缺失的H epG2细胞。
1.3.2 线粒体功能缺失的H epG2 细胞制备参考文献[6] 采用线粒体功能抑制剂羰基氰4-( 三氟甲氧基) 苯腙连续处理H epG2细胞24h,荧光比色法检测线粒体膜电位,确定线粒体功能受损伤,即为线粒体功能缺失的H epG2细胞。
1.4 全基因组表达谱芯片样品制备和检测用TR Izol试剂分别提取正常H epG2细胞和m tDNA 缺失、线粒体功能缺失 H epG2细胞的总RNA,放入-80 ℃ 冰箱中保存并干冰冷冻送样。芯片杂交和检测由上海康成生物公司完成。
1.5 统计分析芯片扫描所得数据用Ag ilent GeneSpring GX 100软件进行计算和处理,组间比较采用t检验。
2 结 果 2.1 m tDNA缺失和线粒体功能缺失对核基因表达影响 2.1.1 差异表达核基因数目的统计分析聚类分析显示,m tDNA 缺失和线粒体功能缺失这2 种细胞中核基因的表达与正常细胞比较均有明显变化。与正常H epG2细胞比较,在 41 000个探针池中,m tDNA缺失的细胞基因表达差异倍数> 2倍的有5 489 个,其中上调的有3 350 个,下调的有2 139 个; 而线粒体功能缺失的H epG2细胞基因表达差异倍数> 2 倍的有3 334个,其中上调的有1 457个,下调的有1 877个。
2.1.2 核基因表达差异程度分析( 图 1)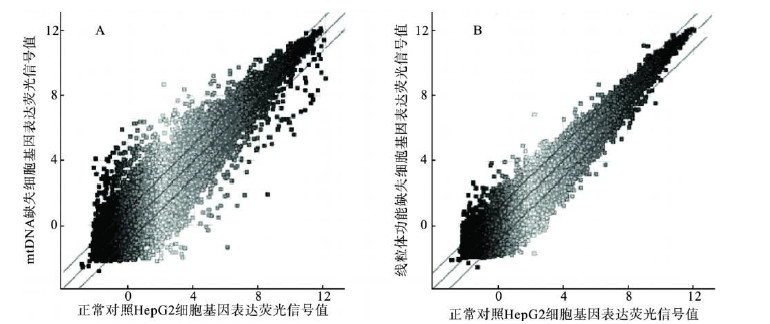 | 注: A: m tDNA 缺失H epG2细胞和正常对照H epG2细胞比较; B: 线粒体功能缺失的H epG2与正常对照组细胞比较 图 1 基因表达荧光信号比值散点图 |
采用2组细胞基因表达的荧光信号比值绘制散点图,愈靠近X 轴或Y轴的点则表明该点基因差异表达愈明显。从散点的分布看,A 中比 B 中靠近X 轴或Y 轴的点更多,其离散程度更大,表明m tDNA缺失H epG2细胞和正常H epG2细胞的基因表达差异比线粒体功能缺失H epG2细胞与正常H epG2细胞表达差异更明显。
2.2 m tDNA缺失和线粒体功能缺失对细胞信号途径影响对上述基因芯片得到的差异表达基因所涉及到的信号途径进行统计分析,结果表明,与正常H epG2细胞比较,m tDNA 缺失细胞中的信号途径差异明显(P < 0.05) 的有315 个,而线粒体功能缺失H epG2细胞,信号途径差异明显( P < 0.05)的有 334个,m tDNA 缺失细胞与线粒体功能缺失细胞比较,信号途径差异明显(P < 0.05)的有188 个,表明m tDNA 缺失和线粒体功能缺失对细胞信号途径均有明显影响,而且它们对不同信号途径的影响又有较大差别。
3 讨 论本研究结果表明,m tDNA 缺失和线粒体功能缺失对核基因的表达均有影响。线粒体是真核生物中细胞的能源中心。 因此,线粒体功能缺失使细胞失去了原动力,从而诱导核基因的异常表达。m tDNA缺失可能是通过胞浆中某些蛋白质的磷酸化和去磷酸化后进入细胞核而引起nDNA 表达的异常,这种线粒体对核基因表达的调控,称为逆行调控[7]。
本研究发现,m tDNA 缺失对核基因表达的影响比线粒体功能缺失的影响更大。进一步研究结果表明,m tDNA缺失和线粒体功能缺失对细胞信号途径均有明显影响,而且它们对不同信号途径的影响又有很大差别。这些信号途径所包含的基因不同,基因的数量也不同,因此,推测对不同信号途径的影响差异可能是m tDNA 缺失比线粒体功能缺失对核基因影响更大的主要原因。与核基因比较,m tRNA 更容易受到环境因素的影响而发生氧化性损伤[8]。因此,m tRNA 缺失对核基因表达的影响可能是多种疾病发病的主要机制,m tRNA缺失和线粒体功能缺失对不同信号途径的影响有待进一步研究。
| [1] | 王学敏,杨雨,李孝基.线粒体和核基因的协作[J].国外医学:分子生物学分册,2000,22(3):171-174. |
| [2] | Taanman JW.The mitochondrial genome:structure,transcription,translation and replication[J].Biochim Biophys Acta,1999,1410(2):103-123. |
| [3] | Vilhelm A B,Tinna S,Nadja C,et al.Mitochondrial DNA repair of oxidative dam age in mammalian cells[J].G ene,2002,286(1):127-134. |
| [4] | 曹军,姜丽平,耿成燕,等.姜黄素致人结肠癌HT-29细胞DNA损伤作用[J].中国公共卫生,2009,25(6):665-666. |
| [5] | Cao J,Liu Y,Jia L.et al.Curcum in induces apoptos is through mitochondrial hyperpo larization and mDtN A damage in human hepatom a G 2 cells[J].Free Radical Biology and Medicine,2007,43(6):968-975. |
| [6] | Koczor CA,Shokolenko IN,Boyd AK,et al.Mitochondrial DNA damage in itiates a cell cycle arrest by a Chk2 associated mechanism in mammalian cells[J].J Biol Chem,2009,284(52):36191-36201. |
| [7] | L ing F,Hori A,Shibata T.DNA recom bination in itiation plays a role in the extremely biased inheritance of yeast[rho] mitochondrial DNA that contains the replication originori5[J].Mol Cell Biol,2007,27(3):1133-1145. |
| [8] | 韩维举,韩东一,杨伟炎.大鼠不同组织器官线粒体DNA缺失定量分析及其老化的关系[J].军医进修学院学报,2002,23(4):305-307. |
 2011, Vol. 27
2011, Vol. 27


