疫苗是防控禽流感的理想方式,但流感病毒基因容易发生变异,给流感疫苗的研发带来困难。研究发现,流感病毒的高变异性与HA和NA基因有关〔1, 2〕。HA和NA的蛋白表型也是流感分型的基础,为探讨研发H5N1亚单位疫苗以及病毒样颗粒疫苗3的生物学基础,本研究将H5N1型禽流感病毒HA和NA基因分别与巴斯德毕赤酵母(Pich ia pasto ris)表达载体pPIC9k重组,成功获得表达质粒pPIC9K-H 5A和pPIC9k-N1A,并电转化毕赤酵母G S115后进行分泌表达。现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 毒株与载体原始毒株avian in fluenza A/Duck/Beijing/2000(H5N1):中国科学院动物研究所国家野生动物疫病研究中心分离并提供;质粒PMD20-T载体(大连TaKaRa公司);p PIC9K和酵母菌株(Pichia pastoris,GS115)(美国Invitrogen公司);大肠埃希菌DH5a(本实验室保存);PET30-H5A重组质粒和pCI-neo-N1A重组质粒(本实验室前期构建并保存)。
1.1.2 主要酶和试剂T4 DNA连接酶,限制性内切酶SnaB I、Not I、Sac I、Sa l I (大连TaKaRa公司);DNA琼脂糖凝胶回收试剂盒,PCR产物回收试剂盒(上海生工生物工程有限公司);DL2000 DNA Marker,低分子量蛋白质Marker (北京B ioTeke公司);Western bloting试剂(美国Santa Cruz公司);抗体(北京中山生物制品公司)。
1.2 方法 1.2.1 引物合成基因序列由大连宝生物工程公司进行测序验证,根据测序结果利用Primer Premier 5软件进行引物设计,在上游引物上加上SnaBI酶切位点,下游引物加上Not 酶切位点。H5A和N1A上游引物和下游引物序列如下(斜体部分为酶切位点):(1) HA上游引物:5 -'ATCTACGTAATGGAGAAAATAGTGCTTC-3;'(2) HA下游引物:5 -'ATTGCGGCCGCTTAAATGCAAATTCT-3;'(3) NA上游引物:5 -'GCGTACGTA ATGAATCCAAATCAGAAAA-3;'(4) NA下游引物:5 -'ATAGCGGCCGC CTACTTGTCAATGGT-3;'引物由上海生工生物工程有限公司合成。
1.2.2 H5A基因和N1A基因PCR扩增以构建好的pET30-H5A重组质粒和H5A上下游引物进行PCR扩增,循环参数为:94 ℃5 min,94 ℃45 s,57 ℃45 s,72 ℃2 min,30个循环;72℃延伸10 min。以构建好的pCI-neo-N1A重组质粒和N1A上下游进行PCR扩增,循环参数为:94℃ 5 min,94℃ 45 s,53℃ 45 s,72℃2 min,30个循环;72℃延伸10 min。扩增完毕后,分别取5 μL PCR产物于0.8%的琼脂糖凝胶进行电泳,检测目的片段H5A和N1A。
1.2.3 目的基因与pMD20-T连接与鉴定PCR产物经0.8%琼脂糖凝胶电泳后,切下目的片段,使用DNA琼脂糖凝胶回收试剂盒进行切胶回收,使用pMD20-T载体进行目的基因连接。将PCR扩增、酶切鉴定均为阳性的克隆,送大连TaKaRa工程公司进行双脱氧终止法序列测定,鉴定正确的重组质粒命名为pMD20-T-H 5A和pMD20-T-N1A。
1.2.4 重组酵母转移载体构建将得到的pMD20-T-H 5A和pMD20-T-N1A分别经No tⅠ和SnaBⅠ双酶切消化后,重复上述步骤处理,并与去磷酸的pPIC9K质粒连接,得到pPIC9K-H5A和pPIC9K-N1A阳性克隆,并进行酶切鉴定、PCR扩增后送大连TaKaRa工程公司进行测序。
1.2.5 转染酵母菌及阳性转化子筛选与鉴定取SalⅠ线性化的重组载体与毕赤酵母GS115感受态细胞混匀,利用电转仪转染酵母菌。电击结束,立即加入冰预冷山梨醇,取转化物涂布营养缺陷型最小葡萄糖(MD)培养基平皿,28℃恒温培养2~4 d,能在MD培养基上生长的菌落为H is+转化子。用灭菌牙签将每个克隆同时点种于氯化镁孔雀绿(MM)、MD平板,30℃培养2~3 d,MM平板上菌落 < MD平板的为MutS表型。
将MD培养基平皿中长出的最初H is+转化子,采用影印法依次接种到含G418浓度梯度为0.5、1.0、2.0、4.0 m g/mL的酵母膏胨葡萄糖(YPD)琼脂培养基中,逐级筛选G418抗性菌株即目的基因高拷贝重组菌株。取单菌落筛选得到的重组多拷贝菌株,提取酵母基因组〔4〕,以其中少量基因组DNA作模板,分别用基因序列引物和载体序列引物,对整合到毕赤酵母GS115染色体DNA中的H 5A和N1A基因进行PCR扩增,根据载体上的引物序列合成引物如下:5'AOX1:5-GACTGGTTCCAATTGACAAGC-3;3'AOX1:5-GCAAATGGCATTCTGACATCC-3。PCR反应条件为:95℃ 5 min;94℃ 50 s,50℃ 50 s,72℃ 50 s,进行30个循环;72℃延伸10 min。扩增结束,各取5 μL反应液进行琼脂糖凝胶电泳观察。
1.2.6 重组酵母菌诱导表达及表达产物检测挑取单个高拷贝重组菌株,接种于YPD液体培养基中,30℃振荡培养过夜。取过夜培养物接种于20 mL缓冲复合甘油培养基(BMGY)培养基中(250 mL摇瓶),30 ℃振荡过夜培养。6 000 r/min离心5 min,无菌条件下收集菌体。加入50 mL缓冲复合甲醇培养基(BMMY)培养基重悬所收集的菌体,30℃在250 mL摇瓶振荡培养,每隔24 h按1%(甲醇与培养基体积比)的比例向锥形瓶中补加无水甲醇以维持甲醇诱导的表达条件,诱导目的蛋白表达。每24 h取l mL诱导培养液上清,12 000 r/min离心5 min,取上清液,-20 ℃冷冻保存。诱导表达144 h后停止诱导,参照分子克隆实验指南(第3版)〔5〕进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白免疫印迹(Western-blotting)分析。
2 结果 2.1 重组pMD20-T-H5A和pMD20-T-N1A的PCR鉴定(图 1)PCR扩增双酶切产物经序列测定,结果显示,经Not I/SnaB I双酶切的pMD20-T-H 5A以及pMD20-T-N1A扩增出2 000 bp左右目的条带,表明正确合成重组质粒pMD20-T-H 5A和pMD20-T-N1A。
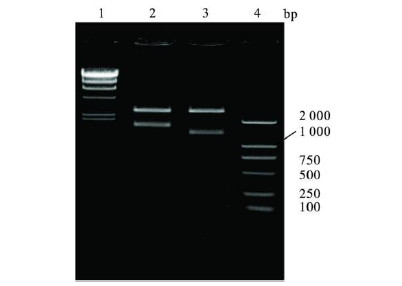 | 注:1:限制性内切酶;2:pMD20-T-H 5A-Not I/Sna B I双酶切;3:pMD20-T-N1A -Not I/Sna BI双酶切;4:DL2000 DNA Marker 图 1 pMD20-T-H5A和pMD20-T-N1A的NotI/Sna BI双酶切产物图谱 |
重组质粒送大连宝生物工程公司进行测序验证结果表明,重组载体p PIC 9K-H 5A和p PIC 9K-N1A扩增出与预期大小相符的条带,表明H 5A和N1A已经正确插入pPIC9K的多克隆位点。
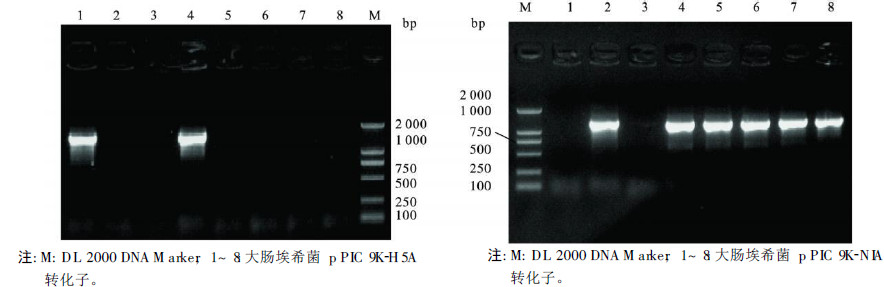 | 图 2 重组酵母载体pPIC 9K-H5A 和pPIC 9K-N1A 的PCR 鉴定 |
携带H is4基因的重组质粒转化缺陷受体菌后,经30℃培养3~6 d,可观察到酵母在MD平板上生长明显快于MM平板,所以转化子为H is+M utS。
2.4 阳性重组子筛选(图 3)在含4.0 mg/mL G418的YPD平板上挑取单克隆菌落接种入液体YPD培养基,过夜培养,提取酵母基因组。以提取到的酵母基因组为模板,用H 5A和N1A上下游引物进行扩增,得到1 704和1 430bp的条带。用合成的5'AOX和3'AOX引物进行PCR扩增,H5A分别在2 200和1 900 bp左右有条带出现,与目的基因(1 704和1 430 bp)加上载体片段(492 bp)的大小相符,表明H 5A和N1A已经整合进毕赤酵母GS115中。
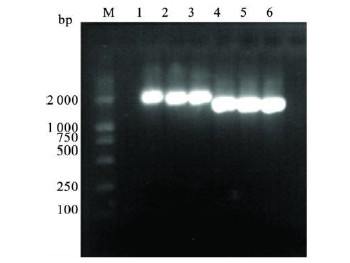 | 注: M: DL2000 DNA M arker; 1~ 3: H5A的PCR条带;4~ 6: N1A 的PCR条带。 图 3 H5A 和N1A 阳性转化子的筛选 |
Western-blotting 检测结果表明,H5A重组蛋白的大小约64 KD,N1A重组蛋白的大小为52 KD。
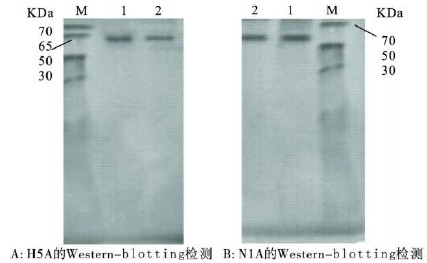 | 注:M.低分子量蛋白M arker;1.GS115/pPIC9k诱导上清;2.GS115/pPIC9K H5A/N1A。 图 4 H5A 和N1A的W estern-blotting检测 |
H5N1型禽流感病毒流行范围遍及全球且危害巨大〔6〕,其抗原蛋白的制备纯化和基因工程疫苗研制有着广阔的前景。禽流感病毒HA可刺激机体产生中和抗体,具有亚型特异性,还可以刺激机体产生细胞毒性T淋巴细胞(CTL)反应〔7〕。NA也是流感病毒重要的表面抗原,具有糖苷外切酶活性,并可促进子代病毒颗粒的成熟和释放,NA还具有免疫原性,其诱导产生的抗体也具有免疫保护作用〔8〕。对H 5N1禽流感病毒的HA和NA片段进行全长克隆,对其致病机制、疫苗研制开发、基因组功能等研究具有重要意义〔9〕。
巴斯德毕赤酵母(Pichia pastoris)是一种甲醇营养型酵母,可利用甲醇作为其唯一碳源〔10〕。目前已有多种外源基因在毕赤酵母中得到了表达。该表达系统的启动子为乙醇氧化酶基因启动子,在该启动子的控制下,外源基因能够得到高水平的表达〔1〕。本研究所采用的pPIC9K载体是一种常用的毕赤酵母表达载体,全长约9 276 bp,载体上有a-facto r分泌信号。本实验成功构建了酵母表达载体pPIC9K-H5A、pPIC9K-N1A,经电转化毕赤酵母GS115和采用G418抗性梯度法筛选得到多拷贝重组菌株后,用甲醇诱导表达得到了H5A和N1A蛋白,并探索了适宜的表达条件,为获得高纯度H 5A和N1A进行H 5N1单克隆抗体的制备提供了可能,同时也为研究H 5N1亚单位疫苗〔12〕以及病毒样颗粒疫苗〔3〕提供基础依据。
| 〔1〕 | 黄平, 柯昌文, 邹丽容, 等.广东地区人禽流感H5N1血凝素基因特征与进化[J].中国公共卫生, 2007, 23(4):390-392. |
| 〔2〕 | StiverHG.The threat and prospects for control of an in fluenza pandemic[J].Expert Rev Vaccines, 2004, 3(1):35-42. |
| 〔3〕 | 吴蒙, 张定梅, 陆家海.流感病毒样颗粒疫苗研究进展[J]. 中山大学学报:医学科学版, 2009, 5(30):486-491. |
| 〔4〕 | 叶玲, 刘建伟, 刘静.酿酒酵母感受态细胞的低温保存及酵母菌落PCR-快速筛选鉴定[J].生物化学与生物物理进展, 2003, 30(6):956-959. |
| 〔5〕 | J.莎姆布鲁克(著), 黄培堂(译).分子克隆实验指南[M].3版.北京:科学出版社, 2002:1428-1480. |
| 〔6〕 | Sym D, Patel PN, El Chaar GM.Seasona, l avian, and novelH1N1influenza:prevention and treamtent modalities[J].Ann Phamracother, 2009, 43(12):2001-2011. |
| 〔7〕 | 南文龙, 金宁一, 鲁会军, 等.H5N 1亚型禽流感病毒血凝素Th和B细胞表位预测及抗原性分析[J].中国免疫学杂志, 2009, 7(25):630-637. |
| 〔8〕 | Mitras inovic PM.A dvances in the structure based design of the in fluenza A neuram in idase inhibitors[J]. Curr Drug Targets.2010, 11(3):315-326. |
| 〔9〕 | 张锦海, 王忠灿, 郑纪山, 等.禽流感病毒H5N 1抗原基因克隆及体外转录[J].中国公共卫生, 2010, 26(4):385-387. |
| 〔10〕 | Li Z, Xiong F, Lin Q, et al.Lowtemperature in creases the yield of biologicallyactive herring an tifreeze protein in Pichia pastoris[J]. Protein Expr Purif, 2001, 21(3):438-445. |
| 〔11〕 | Cregg JM, Cereghino JL, Shi J, et al.Recom binant protein expression in Pichia pastoris[J]. Mol Biotechnol, 2000, 16(1):23-52. |
| 〔12〕 | KeitelW A, A tm r RL.Preparing for a possible pandemic:in fluenza A/H5N1 vaccine development[J].Curr Opin Pharmacol, 2007, 7(5):484-490. |
 2011, Vol. 27
2011, Vol. 27


