黄绿青霉素(citreoviridin,CIT)是黄绿青霉、黄暗青霉、瘿青霉、垫状青霉、毒青霉等青霉菌的次级毒性代谢物,在自然界中广泛存在,容易污染新收获的农作物,使其呈黄绿色霉变,食用后可发生急性中毒,是一种与人类生活密切相关的真菌毒素。现已证明,该毒素具有神经毒作用及致畸性,有研究认为,其可能是克山病的病因〔1〕。该毒素在体外能抑制人类免疫缺陷病毒-1(HIV-1)活性及白色念球菌生长〔2〕。但由于实验用黄绿青霉素价格昂贵,不利于进行深入研究工作,而实验室培养黄绿青霉菌,制备其毒素可受多种条件影响〔3〕。本研究采用黄暗青霉菌,经培养、提取并纯化,合成黄绿青霉素,并观察其对大鼠心肌组织结构和功能的影响。结果报告如下。
1 材料与方法 1.1 材料(1)黄暗青霉菌(Penicillium citreonigrum Dierckx,PCV;中科院微生物研究所);黄绿青霉素(CIT)标准品(美国 SIGMA公司);(2)实验动物:健康雌性W istar大鼠20只(军事医学科学院实验动物中心),体重80~120 g,4周龄,观察和检疫1周后进入实验。(3)仪器与试剂:Olympus光学显微镜(日本奥林巴斯有限公司);超速低温离心机(美国贝克曼库尔特实验室);全自动生化分析仪(日本日立公司);spc- 10Avp液相色谱仪、Uv-V IS检测器(日本岛津公司);数据采集和处理色谱工作站(浙江大学智能信息工程研究所);凯氏振荡器(青岛康信环保设备有限公司);净化工作台(苏州仁川洁净科技有限公司);恒温培养箱(日本三洋公司);手提式压力蒸汽消毒器(江阴滨江医疗设备厂);硅胶G (上海五四试剂厂);琼脂粉(上海晶天生物科技有限公司);乙酸乙酯、正己烷、二氯甲烷、丙酮、甲醇、甲醛、戊二醛,均为国产分析纯。
1.2 方法 1.2.1 黄绿青霉素的生物合成(1)察氏(Czapek-Dox)培养基制备:准确称取NaNO3 3g,K2HPO3 1 g,KCl0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,蔗糖30 g,琼脂20 g,充分溶于1 L水中,高压灭菌,倒入已灭菌培养皿中备用。(2)黄暗青霉菌培养及毒素提取:将产毒黄暗青霉菌接种在察式培养基上,25 ℃培养14 d,可观察到浅黄、黄白或灰绿色菌落,基底呈现黄色及表面有渗出液。将玉米浸泡后高压灭菌,加入30%无菌水后,接种含有黄暗青霉菌孢子的琼脂,于25 ℃培养3~5 d,肉眼观察其长出白色或绿色菌株,再于15℃培养14~21 d,玉米呈黄绿色变。黄变的黄暗青霉菌培养物60~70 ℃干燥,磨粉,无水乙醇萃取。将萃取液于旋转蒸发器上60~70℃减压浓缩,得棕色油状乙醇提取物。(3)黄绿青霉素纯化:将乙醇提取物溶解于热苯中,4 ℃放置数天,滤纸过滤,弃去不溶于苯的棕色物,逐滴加入正己烷于黄色苯溶液中,生成黄色沉淀,即乙醇原毒素。将乙醇原毒素用硅胶柱预处理。流出液为正己烷+丙酮(1:1);将黄色流出液浓缩蒸干,将其溶于甲醇溶液中,可见黄绿青霉素的黄色粉末生成。
1.2.2 黄绿青霉素含量检测将已蒸干的乙醇提取物及最后生成的黄绿青霉素,参照文献〔4〕方法,采用高效液相色谱法检测黄绿青霉素含量,计算公式:C=(A/A´)×(I´/I)× S × (V/W),其中C为黄绿青霉素质量分数(ng/g),A为样品峰面积总计,A´为标准品平均峰面积总计,I´为标准品容积 (μL),I为样品容积(μL),S为黄绿青霉素标准品浓度(mg/ L),V为样品终容积(μL),W为样品质量(g)。
1.2.3 实验分组实验动物随机分为2组,每组10只。其中正常对照组饲以普通饲料;实验组每日喂饲15 mg/kg CIT,CIT含量随大鼠体重增加而增加。饲养温度为18~24 ℃,湿度40%~60%,12 h白昼,12 h黑暗。8周后,股动脉取血,分离血清;同时剪取心肌组织,部分心肌组织分别用10%甲醛和4.5%戊二醛固定。
1.2.4 观察指标心肌组织甲醛固定,常规石蜡包埋,苏木素(伊红染色,光学显微镜观察心肌组织病理学改变;电子显微镜观察心肌细胞超微结构的改变;采用全自动生化仪检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶 (ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)及其同工酶(CK-M B)含量;采用化学发光法检测血清中肌钙蛋白T含量。
1.3 统计分析采用SPSS 11.0软件进行统计分析,各项酶学指标比较采用方差分析,血清肌钙蛋白T含量比较采用秩和检验。
2 结 果 2.1 乙醇提取物及生成的黄绿青霉素色谱图比较(图 1~3)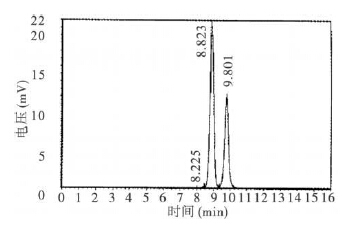 | 图 1 黄绿青霉素标准色谱图 |
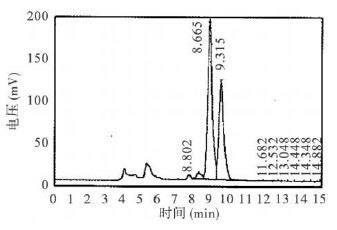 | 图 2 黄暗青霉菌乙醇提取物色谱图 |
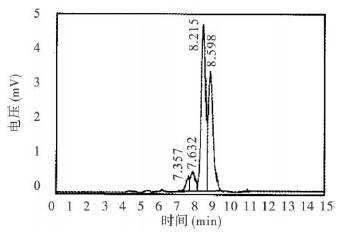 | 图 3 合成的黄绿青霉素色谱图 |
样品进样量20 μL,标准物为50 μg/L。黄绿青霉素标准品呈双峰图谱,保留时间为8.5~10.5min (图 1);黄暗青霉菌乙醇提取物杂峰较多,表明该提取物中除黄绿青霉素外还含有大量其他物质(图 2);合成的黄绿青霉素杂峰明显减少,所含成分较单一,杂质较少,经检测,黄绿青霉素为196.5mg/kg (图 3)。
2.2 黄绿青霉素对大鼠心肌组织结构和功能影响(图 4,5) | 图 4 黄绿青霉素作用后大鼠心肌细胞变化 |
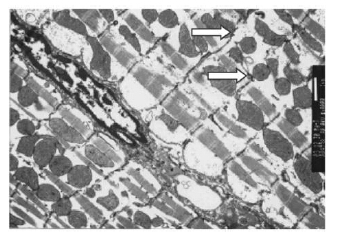 | 注: 核固缩呈凋亡状态, 核周大量肌丝溶解, 结构明显紊乱、增粗, 线粒体减少。 图 5 实验组心肌细胞电子显微镜图 |
光学显微镜下可见,实验组大鼠心室肌均出现明显病变,病变呈灶状或条索状分布,涉及范围较大,有大量淋巴细胞和单核细胞浸润,间质水肿(图 4A,图 4B),心肌细胞呈颗粒变性,肌浆凝聚,肌原纤维凝集、崩解,部分心肌细胞空泡变性(图 4C)。电子显微镜下可见,实验组心肌细胞核固缩呈凋亡状态,核周大量肌丝溶解,肌丝结构明显紊乱、增粗,肌丝间出现大量低电子密度区,线粒体数量减少。
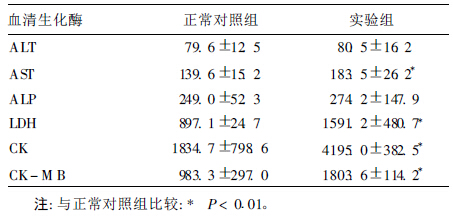
2.3 黄绿青霉素作用后大鼠血清酶学变化(表 1)| 表 1 黄绿青霉素对大鼠血清酶影响(U/L,x ± s) |
实验组谷草转氨酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)及其同工酶(CK-MB)4项均明显高于正常对照组(P < 0.01),2组之间谷丙转氨酶(ALT)和碱性磷酸酶(ALP)的差异无统计学意义(P > 0.05)。表明黄绿青霉素作用后,部分心肌酶活性明显降低,功能下降。同时,正常组所有大鼠血清肌钙蛋白T含量均低于0.01 ng/mL,实验组则有半数大鼠血清肌钙蛋白T含量在0.45 ng/mL以上,高出正常对照组40~50倍,差异有统计学意义(P < 0.01)。
3 讨 论研究表明,不同温度、pH值以及不同培养时间对黄绿青霉菌产毒量均有较大影响〔5〕。本实验所合成的黄绿青霉素所含成分较单一,杂质较少,产出量为196.5 mg/kg,与文献报道结果相近〔5, 6〕,表明本实验的培养温度湿度、时间,pH值以及提取方法、溶剂及检测方法的选择比较合适,纯化效果较好。大鼠实验结果表明,所合成的黄绿青霉素可引起心肌细胞结构和功能的明显变化,导致大鼠心肌发生变性和坏死,呈灶状散在,涉及面较大,有炎性细胞浸润,心肌细胞呈空泡样变,间质水肿,横纹消失。电镜下心肌细胞核固缩呈凋亡状态,核周肌丝溶解,结构紊乱,线粒体数量减少,与有关研究结果一致〔7〕,同时还明显抑制大鼠血清中多种酶的活性。
本实验成功制备了黄绿青霉素,并可引起大鼠心肌改变和影响血清酶活性。今后应对提取、纯化效果的影响因素进行研究,以期获得最佳实验条件。
| 〔1〕 | Sun S.Chronic exposure to cerealmycotox in likely citreoviridin may be a trigger for Keshan diseasemainly through oxidative stress mechanism[J].Medical Hypotheses,2010,74:841-842. |
| 〔2〕 | Vieta I,Savarino A,Papa G,et al.In vitro inhibitory activity of citreoviridin against HIV-1 and an HIV-associated opportunist Candida albicans[J]. J Chemother,1996,8(5):351-357. |
| 〔3〕 | 侯海峰,李群伟.黄绿青霉素的研究进展[J].临床药学,2005,11 (2):177-178. |
| 〔4〕 | 李德安,孙树秋,李晓丹,等.黄绿青霉素的高效液相色谱法检测[J].中国地方病学杂志,2004,23(2):160-162. |
| 〔5〕 | 侯海峰,李群伟,齐永秀.不同条件对黄绿青霉菌产毒的影响[J].中国公共卫生,2006,22(7):811-812. |
| 〔6〕 | 侯海峰,齐永秀,李群伟.度和pH的交互作用对黄绿青霉菌产毒影响[J].温中国公共卫生,2007,23(1):52-53. |
| 〔7〕 | 刘密凤,王丽华,林林,等.黄绿青霉素对心脏毒性损伤作用[J]. 中国公共卫生,2007,23(5):565-567. |
 2010, Vol. 26
2010, Vol. 26