肠道中存在大量细菌,它们定植于肠道粘膜表面,与肠道粘膜细胞共同构成生物屏障,保护宿主抵御外来微生物的侵袭,其中生理性细菌以乳酸杆菌和双歧杆菌及一些厌氧菌最常见。已有研究证实,服用外源性益生菌特别是双歧杆菌、乳酸菌等,对维持机体微生态稳定、抑制病原微生物侵袭、调节免疫防御方面有重要作用〔1, 2〕。为探讨双歧杆菌乳酸菌三联活菌片中益生菌对肠道致病菌入侵肠屏障的预防保护作用,探讨其发挥调节肠道微生态平衡的功能,进行了本实验研究。结果报告如下。
1 对象与方法 1.1 材料(1)实验动物:SPF级健康BALB/c雌性小鼠40只,6~8周龄,体重18~22 g (SCXK粤2006-0015,南方医科大学实验动物中心)。(2)菌株:大肠埃希菌(E.coli) K1:分离自脑膜炎患儿脑脊液中;肺炎克雷伯菌分离自南方医院神经内科,2株致病菌经Luria-Bertanimedium (LB)培养基37℃培养12 h后,12 000 r/min,4℃离心5 min,菌体用无菌磷酸盐缓冲溶液(PBS)重悬,调整到吸光度(A)600=0.6左右。 (3)主要试剂与仪器:双歧杆菌乳杆菌三联活菌片(批号 20080402,内蒙古双奇药业股份有限公司);Mx 3005P型荧光定量PCR仪(上海吉泰生物公司),Bio-Rad D-Code System (美国biorad公司),蠕动泵(北京六一仪器厂),变性梯度凝胶电泳系统(美国cbs公司),细菌基因组提取试剂盒TIANamp Bacteria DNA Kit (德国Q IAGEN公司)。
1.2 方法 1.2.1 益生菌肠道定植时间观察SPF级BALB/c小鼠10只,每天用活菌片PBS稀释液灌胃,活菌浓度为1× 106~1×107 CFU/mL,每天2次,连续14 d,每天取肠道标本连续观察益生菌粘附情况。
1.2.2 实验分组根据益生菌在小鼠肠道稳定定植时间,确定第7 d为小鼠预防性服用益生菌截止时间。将SPF级 BALB/c小鼠40只,随机分为(1)益生菌组:每天用活菌片稀释液灌胃2次,活菌浓度为1×106~1×107 CFU/mL,连续7 d,第8 d用0.2 mL PBS灌胃2次;(2)益生菌+致病菌组:每天用活菌片稀释液灌胃2次,活菌浓度为1×106~1×107 CFU/mL,连续7 d,第8 d用E.coli K1和肺炎克氏菌混合物 0.2 mL灌胃2次,菌液浓度为1×109~2×109 CFU/mL;(3)致病菌组:每天用PBS 0.2 mL灌胃2次,连续7 d,第8 d用 E.coli K1和肺炎克氏菌混合物0.2 mL灌胃2次,菌液浓度为1×109~2×109 CFU/mL;(4)对照组:每天用PBS 0.2 mL灌胃2次,连续8 d。致病菌组和益生菌+致病菌组分别于第 8、9 d采取粪便标本,对照组和益生菌组分别于第8 d采取粪便标本。
1.2.3 细菌DNA提取取0.05 g新鲜粪便标本,加入200 μL裂解缓冲液(醋酸钠100 mmol/L,乙二胺四乙酸50 mmol/ L,氯化钠500 mmol/L,十二烷基硫酸钠1.4%),充分颠倒混匀10 min,沸水煮5 min,立即放入冰水中冷却3 min,14 000 r/m in离心3 min,收集100 μL上清液,加入8 μL蛋白酶k,采用T IANam p Bacteria DNA Kit抽提细菌基因组,具体操作步骤按说明书。
1.2.4 特异引物设计双歧杆菌、保加利亚乳杆菌通用引物 16S rRNA参照文献〔3, 4〕;E.coli K1引物设计,登陆Gene-Bank,查找大肠埃希菌侵袭素(IbeA)基因;肺炎克氏菌溶血素(hemolys in)基因由引物设计软件Prim erExpress设计引物,最后通过blast数据库验证引物特异性。各引物序列如下。双歧杆菌16S rRNA:f 5´-TCGCGTCCGGTGTGAAAG-3´,r:5´- CCACATCCAGCATCCAC-3´,扩增长度243 bp;保加利亚乳杆菌16S rRNA:f 5´-ACATGAATCGCATGATTCAAG-3´,r:5´-AACTCGGCTACGCATCATTG-3´,扩增长度106 bp;大肠埃希菌IbeA:f 5´-GTACTGGCAACCACGGAAGT-3´,r:5´-CCATT-GATTTTGCCGTTTCT-3´,扩增长度232 bp;肺炎克氏菌hemoly sin:f 5´-GGGAGAAAACGATGAAACGA-3´,r:5´-ATAGC-CCTCCAGCACGTAGA-3´,扩增长度236 bp。
1.2.5 基因组DNA抽提取0.5 g活菌片,加入1 mL裂解缓冲液溶解,DNA提取同1.2.2;取E.coli K1和肺炎克氏菌培养液1 mL,采用煮沸法抽提细菌基因组。
1.2.6 外标准品与标准曲线制备参照陈津津等〔5〕方法进行外标准品制备和标准曲线制作,采用M x3005P型荧光定量 PCR仪进行扩增与分析,PCR反应条件:95℃预变性10 s,95℃变性15 s,62℃退火15 s,72℃延伸15 s,循环40次。
1.2.7 粪便标本中益生菌和致病菌含量检测采用实时荧光定量聚合酶链式反应(SYBR Green IRea l-time PCR)方法检测〔3, 4, 5〕,将待测样品DNA抽提液按与制备标准曲线相同的反应体系和反应条件进行,每次实验都设阴性对照和标准品校正,每个样品做3个平行复孔,扩增完毕后,进行溶解曲线分析。
1.2.8 变性梯度凝胶电泳(DGGE)及染色以肠道总细菌 16S rDNA可变区V3区为靶标,进行PCR扩增,引物序列〔6〕 V3-357f-GC (5´-cgcccggggcgcgccccgggcgggg cgggggcacgg-ggggtacggg aggcagcag-3´);V3-R519(5´-attaccgcggctgctgg-3´)。参照Zárate G等〔7〕方法,对16S rDNA V3可变区序列的扩增产物进行DGGE分析。DGGE使用10%聚丙烯酰胺凝胶,将 100%变性梯度定义为含40%(v/v)甲酰胺和7 mol/L尿素,采用35%~65%的变性梯度。电泳采用DGGE-2001-220型变性梯度凝胶电泳系统,首先在150 V电压下预电泳2 h,随后在200 V的固定电压下电泳1.5 h。电泳结束后,进行硝酸银染色〔8〕。DGGE凝胶采用RIO-RAD Quantity One-4.6.2软件进行图像分析,及相似性聚类分析,同时进行肠道微生物菌群多样性分析〔6〕,内容包括丰富度(richness,S)、微生物区系的Shannon-Wiener指数(H´):H´=-∑PilnP;i微生物区系的菌群均匀度(Even-ness,E):E=H´/H´max,其中H´max=lnS。
1.3 统计分析采用SPSS 13.0软件进行统计分析,结果以 x±s表示,采用t检验比较组间差别,P < 0.05为差异有统计学意义。
2 结 果 2.1 益生菌肠道定植时间随着活菌片的服用,肠道定植的 2种益生菌逐渐增加,到第7 d时定植达到稳定,随服药次数增加定植数量没有变化,所以益生菌+致病菌组采取第8 d时给予致病菌干预。图 1可见,原小鼠肠道中并无保加利亚乳杆菌存在,随时间增加,肠道中逐渐出现定植。服药前小鼠肠道中即有双歧杆菌定植,随时间增加定植逐渐增多。
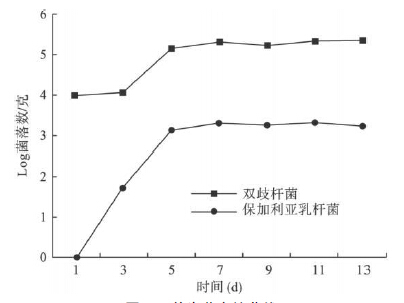 | 图 1 益生菌定植曲线 |
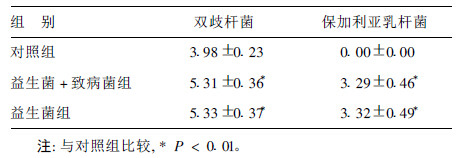
| 表 1 双歧杆菌和乳杆菌定量( log10N /g 湿便, x ± s, n= 10) |
益生菌+致病菌组和益生菌组中双歧杆菌和保加利亚乳杆菌含量差异无统计学意义,但均高于对照组。
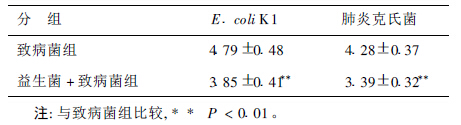
2.3 粪便标本E.coli K1和肺炎克氏菌定量(表 2)| 表 2 不同处理组E.coliK1定量( log10N / g湿便, x ± s, n= 10) |
益生菌 +致病菌组中E.coliK1和肺炎克氏菌含量低于致病菌组,说明益生菌可以减少肠道致病菌定植。
2.4 肠道细菌16S rDNA V3区序列比对与多样性分析(图 2,表 3)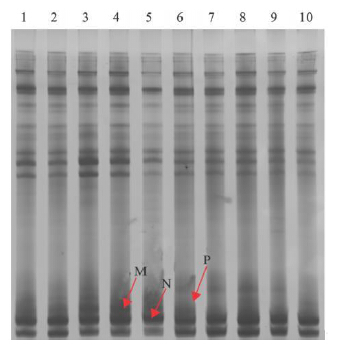 | 注: 1~ 5 : 对照组; 6~ 10 : 益生菌组; M、N、P。 图 2 肠道细菌16S rDNA V3区引物的DNADGGE电泳图谱 |
| 表 3 V3区引物DGGE图谱的多样性指数分析( n= 5, x ± s) |
图 2可见,2组位置相同的条带较多,表明大多为共有菌株。相似性聚类分析结果显示,益生菌组组内个体相似性比对照组提高,表明服用益生菌后可减少宿主及环境的很多因素影响,提高了肠道菌群构成的一致性,提高肠道微生态的稳定性。益生菌组与对照组相比,多样性指数分析均无明显差异,说明益生菌的服用并未影响正常肠道菌群结构。
3 讨 论近年来,随着微生态学的发展,人们渐渐认识到益生菌在治疗和预防某些疾病方面的重要性〔8〕。有研究表明乳酸菌服用可以预防和治疗泌尿生殖道感染,可以抑制致病微生物粘膜定植〔9〕。 E.coli K1和肺炎克氏菌是新生儿时期中枢神经系统最常见致病菌,存在于肠道,其致病主要是通过粘附于肠粘膜表面,当机体免疫力降低导致菌群失调时引起感染。本研究结果显示,益生菌+致病菌组中的2种致病菌肠道定植量均比致病菌组明显减少,提示外源性益生菌可能成为维护肠屏障功能的新途径。体内研究证实,活菌片中的益生菌有一定粘附能力,灌胃给药到第7 d时,益生菌粘膜定植数达到稳定,与文献报道一致〔8〕。正常小鼠肠道菌群的多样性和相似性结果表明,服药前小鼠个体之间有差异,服用益生菌后这种差异性减小,说明正常机体条件下,外源性益生菌的服用可起到微生态调节作用,提高机体对致病菌的抗感染能力。多样性分析同时证实益生菌的连续多次服用,对正常小鼠的肠道稳态并未造成大的影响。
| 〔1〕 | Pan WH,Li PL,Liu ZY,et al. The correlation between surface hydrophobicity and adherence of Bifidobacterium strains from centenarians faeces[J].Anaerobe,2006,(12):148-152. |
| 〔2〕 | Servin A L.Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens[J].FEM S Microbiology Review s,2004, 28:405-440. |
| 〔3〕 | Balamurugan R,Janardhan HP,George S,et al. Molecular studies of fecal anaerobic commensal bacteria in acute diarrhea in children[J].Journal of Pediatric Gastroen terology and Nutrition,2008,46 (5):514-519. |
| 〔4〕 | Furet JP,Qune P,Tailliez P.Molecular quantification of lactic acid bacteria in fermented milk products using real time quantitative PCR[J].International Journal of Food Microbiology,2004,97(2): 197-207. |
| 〔5〕 | 陈津津,蔡威.应用real time PCR测定幼兔肠道内双歧杆菌和乳杆菌的变化[J].世界华人消化杂志,2007,15(31):3278-3283. |
| 〔6〕 | Pham LC,RolingW F,Prosperi A C,et al. Effects of probiotic Lactobacillus salivarius W 24 on the compositional stability of oralmicrobial communities[J].Arch Oral Biol, 2008,54(2):132-137. |
| 〔7〕 | Zárate G,Santos V,Nader-Macias M E.Protective effect of vaginal Lactobacillus paracasei CRL 1289 against urogenital infection produced by Staphylococcus aureus in a mouse animal model[J]. Infect Dis Obstet Gynecol.2006,43(2):174-180. |
| 〔8〕 | 吴小南,陈忠龙,陈洁发,等.发酵莲子乳对小鼠肠粘膜屏障保护作用[J].中国公共卫生,2008,24(6):675-677. |
| 〔9〕 | McLean NW,Rosenstein IJ.Characterization and selection of a Lactobacillus species to recolonise the vagina of women with recurrent bacterial vaginosis[J].J Med Microbiol, 2000,49:543-552. |
 2010, Vol. 26
2010, Vol. 26

 , 龙敏, 张文炳, 黄胜和
, 龙敏, 张文炳, 黄胜和