食品添加剂明矾(硫酸铝钾)与人们的日常生活密切相关,广泛用于油炸食品、发酵食品、膨化食品及腌渍海产品、制作粉条等〔1〕。目前在食品加工制作过程中过量使用明矾现象比较严重,造成食品中铝元素含量超过国家标准〔2, 3〕。铝是对人体有害的金属元素,过量铝可在人体蓄积,产生慢性毒性作用,其中对神经系统损害最为严重〔4, 5〕,能导致多种神经性病变,但是其损伤机制目前仍不清楚。本实验通过给大鼠饲喂添加明矾饲料,测定大鼠脑组织中丙二醛(MDA)含量及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,同时测定大鼠脑组织中铜、锰、铁、锌等金属元素的含量,探讨明矾对大鼠神经损伤机制。
1 材料与方法 1.1 仪器与试剂SOLLAR M6 型原子吸收光谱仪,带GF95型石墨炉,FS95自动进样装置(美国热电公司);ETHOS-TC微波消解仪(意大利Milestone公司);UV-2450型紫外可见分光光度计(日本岛津公司);ER-182A万分之一电子天平(日本A&D公司);明矾(食品添加剂);铝、铁、锌、铜、锰标准液(国家标准物质研究中心);MDA、SOD、GSH-Px、蛋白试剂盒(南京建成生物工程研究所);其余试剂均为分析纯。
1.2 实验动物及染毒选择健康清洁级雄性Wistar大鼠(山东大学实验动物中心),32只,体重160~180g,动物许可证号:SCXK(鲁)20090001,分笼饲养,自由进食饮水。动物房温度为16~24℃,相对湿度为45%~55%,适应环境饲养3d。大鼠按体重随机分为4组,每组8只。对照组,给予基础饲料;低、中、高剂量明矾组大鼠饲料中添加不同剂量食品添加剂明矾,对照组与低、中、高明凡组饲料中铝含量实测值分别为59.7,887,1730.6,2610.7mg/kg。饲喂30d,每天称量体重及进食量。
1.3 脑组织MDA 及SOD、GSH-Px 测定实验结束后,大鼠禁食24h,断头处死,在冰台上剥离出全脑,精确称取脑组织,用4℃生理盐水(体积9:1)低温匀浆,3000r/min离心15min,取上清备用,采用试剂盒法测定脑组织中蛋白质、MDA含量及SOD、GSH-Px活性。
1.4 金属元素分析精确称取脑组织约0.1g,于微波消解仪内插罐中,加1mL硝酸,冷消解1~1.5h,放入加有1mL双氧水和5.0mL去离子水的内罐中,消化,同时做空白,组织消解完全后,定容至5.0mL。Al、Mn、Cu含量的测定采用石墨炉原子吸收光谱法进行测定,Al的测定线为309.3nm,Cu的测定线为324.8nm,Mn的测定线为279.5nm,均以氩气作为载气,采用塞曼效应扣除背景吸收。Fe、Zn含量的测定采用火焰原子化法,Zn的测定线为213.9nm,Fe的测定线为248.3nm,燃气为空气-乙炔。
1.5 统计分析采用SPSS 13.0统计软件对数据进行分析,多组间数据分析采用单因素方差分析,组间两两比较采用Dunnett检验,以P<0.05表示差异具有统计学意义。
2 结果 2.1 明矾对大鼠体重及进食量影响实验期间4组大鼠的平均进食量无差异,体重均呈增长趋势,但与对照组比较,实验组大鼠体重增长缓慢,在实验结束时各剂量明矾组大鼠体重明显低于对照组(P<0.01)。
2.2 大鼠脑组织中MDA、SOD 和GSH-Px 变化( 表 1)
表 1 明矾对大鼠脑组织中MDA、SOD 和GSH-Px 影响(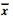 ±s,n = 8) ±s,n = 8) |
结果表明,随着饲喂明矾量的增加,低、中、高剂量组大鼠脑组织中MDA含量逐渐升高,与对照组比较差异具有统计学意义(P<0.01),高剂量组SOD活性明显低于对照组(P<0.05),与对照组比较,中、高剂量组GSH-Px活性明显下降(P<0.05)。
2.3 脑组织中铝、铜、锰、铁、锌含量测定结果( 表 2)
表 2 明矾对大鼠大脑中金属元素含量的影响(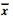 ±s,μg/g,n= 8) ±s,μg/g,n= 8) |
结果表明,低、中、高剂量组大鼠脑组织中铝含量随着饲喂明矾剂量增加而升高,与对照组比较差异具有统计学意义(P<0.01),与对照组比较,高剂量组大鼠脑组织中铜含量降低,差异具有统计学意义(P<0.05),各实验组大鼠脑组织中锌含量明显降低(P<0.05)。
3 讨论铝能导致多种神经性疾病,但是关于其神经病理机制尚存在争论,有文献报道铝元素通过转运蛋白和非转运蛋白等方式突破血脑屏障,导致神经性病变〔6〕,而Kumar等〔7〕则认为铝通过破坏机体线粒体功能提高机体氧化应激,逐步对生物体造成损害。本研究结果显示,随着饲喂明矾剂量增加,低、中、高剂量组大鼠的进食量无明显变化,但体重增长缓慢,提示明矾影响大鼠体重增长,这可能与经口摄入明矾影响大鼠胃肠道吸收营养的功能有关。
本实验结果还显示,实验组大鼠脑组织中SOD和GSH-Px活性下降,MDA含量升高。SOD及GSH-Px是机体内重要的抗氧化酶类,能有效维持抗氧化系统的平衡,明矾的摄入在一定程度上降低大鼠脑组织SOD和GSH-Px的活性,导致机体清除氧自由基的能力降低,加速机体氧化损伤进程,增强脂质过氧化反应,产生大量脂质过氧化产物MDA。MDA与膜上的蛋白质或脂质发生反应,破坏生物膜结构完整性,损害细胞正常生理功能。
随着明矾饲喂剂量增加,实验组大鼠脑组织中铜、锰、铁、锌元素含量降低,而金属元素铜、锰、锌是组成SOD重要成分,机体铜、锰、铁、锌元素含量下降会降低SOD和GSH-Px活性,导致机体不能及时清除包括MDA在内的氧自由基,加重机体脂质过氧化损伤。
| 〔1〕 | 中国食品添加剂生产应用工业协会.食品添加剂手册[M].北京:中国轻工业出版社,2001,58. |
| 〔2〕 | 叶蔚云,雷宇绯,陈秀端.广州市几类食品中铝的测定[J].中国卫生检验杂志,2007,17(6):1018-1019,1047. |
| 〔3〕 | 何福德,陆鹏,姚创飞,等.市售面点中铝残留量的调查[J].中国卫生检验杂志,2006,16(9):1113-1114. |
| 〔4〕 | 邢伟,文涛,王彪,等.铝对大鼠海马〔Ca2+〕i和PKC生物活性影响[J].中国公共卫生,2007,23(5):579-580. |
| 〔5〕 | Nayak P.Aluminum:impacts and disease[J].Environmental Research,2002,89(2):101-115. |
| 〔6〕 | Yokel RA.Blood-brain barrier flux of aluminum,manganese,iron and other metals suspected to contribute to metal-induced neurodegeneration[J].Joural of Alzheimers Disease,2006,10(2-3):223-253. |
| 〔7〕 | Kumar V,Gill KD.Aluminum neurotoxicity:neurobehavioural and oxidative aspects[J].Archives of Toxicology,2009,83(11):965-978. |
 2010, Vol. 26
2010, Vol. 26

 , 贾晓静, 曹胜楠, 张贝贝
, 贾晓静, 曹胜楠, 张贝贝 
