2. 湘南学院图书馆;
3. 湖南省郴州市第一人民医院检验科
Fas是近年来研究最为深入的有关细胞凋亡的膜表面分子,研究Fas在凋亡中的作用机制,对了解细胞凋亡有重要意义。酵母作为一种容易进行操作的生物模型,广泛应用于异基因表达、结构与功能和细胞的凋亡研究中〔1, 2〕。氯化镧水杨酸8-羟基喹啉三元稀土配合物[La(Sal)2(Qu)]具有抗真菌和细菌作用,也具有促细胞凋亡作用〔3〕,为了探讨La(Sal)2(Qu)促凋亡的作用机制,本研究课题在粟酒裂殖酵母中表达Fas并观察了对酵母存活的影响,分析了La(Sal)V2(Qu)对不同凋亡通路之间的相互作用关系。结果报告如下。
1 材料与方法 1.1 菌株和质粒大肠埃希菌菌株DH5α,粟酒裂殖酵母(Schizosaccharomycespombe,S.pombe)菌株leu-ura-h+,表达质粒pREP3X-HA(haemagglutinin,HA血细胞凝集素),Jurkat细胞均由西班牙萨拉曼卡大学的FaustinoMollinedo教授赠送。pREP3X-HA质粒含nmt1启动子、HA和his3基因,nmt1启动子可以通过硫胺素调节表达,HA基因编码血细胞凝集素抗原决定簇。
1.2 酶和试剂限制性内切酶(美国MBIFermentas公司),Taq酶、脱氧核苷酸(dNTPs)、DNAmarker、5-溴-4-氯-3-吲哚半乳糖苷(5-bromo-4-chloro-3-indolyl-β-D-galactoside,X-gal)、异丙基-β-D-硫代半乳糖苷(isopropyl-thio-β-D-galactopyranoside,IPTG)、胶回收试剂盒(SK1131)和PCR引物(上海生工生物工程有限公司);连接酶和DeadEndTMFluorometricTUNELSystem试剂盒(美国Promega公司);抗HA抗原决定簇抗体、抗Fas抗体,羊抗鼠HRP抗体、羊抗兔HRP抗体(美国Pierce公司);其他试剂均为市售分析纯。
1.3 Fas基因的合成与克隆 1.3.1 Jurkat细胞Fas基因的合成应用酚-氯仿抽提法〔4〕 制备Jurkat细胞RNA,然后应用逆转录-聚合酶链反应(RTPCR) 合成其cDNA,以该cDNA为模板经PCR合成Fas基因。
1.3.2 Fas基因的克隆和鉴定4%琼脂糖电泳PCR产物,回收目的条带,按照SK1131胶回收试剂盒说明书回收目的 片段,与T载体连接过夜,转化DH5α感受态细胞,涂布在带 有半乳糖苷(X-gal)和(IPTG)的氨苄平板上,挑选白斑克隆,提取质粒后,分别用SalI和NotI单酶切验证为阳性克隆后,送上海生工生物工程有限公司测序。
1.4 pREP3X重组质粒载体的构建和鉴定pREP3X-HA质 粒与Fas基因克隆和转染参考本实验室以前的方法〔5〕。重组 质粒命名为pREP3X-HA-Fas。
1.5 裂殖酵母的转化和鉴定 1.5.1 酵母的转化参考文献〔6〕的方法进行电转化。转化 条件为:1.5kV,132Ω,40μF。
1.5.2 转化子的鉴定转化平板上挑取单菌落,接种于Edinburgh minimalmedium(EMM)基本培养基培养至A5951.0左 右,取菌液1.5mL,离心(3000g)10min收集细胞,重悬于 STET缓冲液(8%蔗糖,5 %TritonX-100,50mmol/L乙二胺 四乙酸二钠盐和50mmol/LTris-HCl,pH8.0)100μL,短暂振 荡后热水浴加热3min;冰上降温数秒,离心,上清转移,加入 醋酸铵(7.5mol/L)50μL,-20℃存放1h后离心;上清转 移,加入2倍体积乙醇沉淀DNA,70%乙醇洗涤,加水溶解。 10μL提取的DNA转化感受态大肠埃希菌DH5α,过夜培养 后,挑取单菌落,液体培养,提取质粒,电泳,与pREP3X-HAFas 比较大小。
1.6 蛋白表达产物的鉴定将未转化的酵母、pREP3X-HA 质粒转化的酵母和pREP3X-HA-Fas重组质粒转化的酵母在 EMM培养基中于32℃培养。参考文献〔7〕方法,分别提取各 组转化酵母细胞蛋白后,取30μg蛋白进行十二烷基磺酸钠 (sodiumdodecylsulfate,SDS)凝胶电泳将蛋白进行分离后,将 其转移至硝化纤维上,用抗HA抗原决定簇抗体或抗Fas抗 体作为一抗,应用羊抗鼠辣根过氧化物酶(HRP)或羊抗兔 HRP作为二抗,按试剂盒说明进行操作,染色蛋白条带,并进 行拍照。
1.7 表达产物活性的鉴定将酵母细胞分为3组(野生型酵 母对照组,重组酵母对照组和重组酵母处理组),处理组细胞 生长于含有2%半乳糖的MM(minimalmedium)液体培养基 中,并加入2.0μmol/L的La(Sal) 2 (Qu)处理6h以诱导粟酒 裂殖酵母产生凋亡应答〔5〕。而对照组则未经La(Sal) 2 (Qu) 处理。处理结束后,对细胞分别进行原位末端标记(TUNEL) 试验和碘化丙锭(PI)染色法流式细胞术检测〔5〕。
1.8 统计分析采用SPSS 13.0软件进行统计,计数资料组间差异用 单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 Fas基因的扩增PCR产物电泳后,大小为1007bp左 右,连接到T载体上,经上海生工生物工程有限公司测序,序 列正确。
2.2 穿梭载体的构建连接产物的转化菌,提取质粒经SalI 和NotI酶的单酶切和双酶切,同时以pREP3X-HA为对照,酶 切产物进行琼脂糖电泳。电泳结果表明,双酶切片断长度约 为1007bp左右,大小与Fas基因相当,表明Fas基因已被克 隆至该位点。酶切验证阳性的重组质粒,经上海博亚测序,序 列正确。
2.3 酵母转化子的鉴定从酵母转化子提取的质粒,转化大 肠埃希菌扩增后,与pREP3X-HA-Fas同时进行电泳试验,比 较质粒大小。电泳结果表明,酵母质粒与重组质粒大小一致。
2.4 蛋白表达产物的鉴定(图 1,2)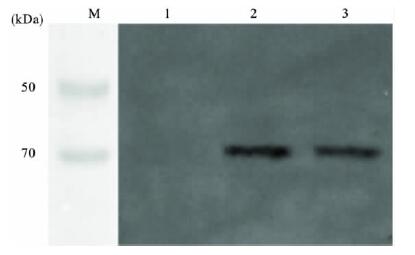 | 注: M-DNA 分子量标准; 1: S.pombe 野生型; 2: 转录了HA 基因的S.pombe; 3: 转录了HA和Fas基因的S.pombe。图 1 粟酒裂殖酵母细胞蛋白表达产物HA 表达图谱 |
 | 注: M-DNA 分子量标准; 1: S.pombe野生型;2: 转录了HA 基因的S.pombe; 3: 转录了HA和Fas基因的S.pombe。图 2 粟酒裂殖酵母细胞蛋白表达产物Fas 表达图谱 |
在表达产物鉴定试验 中可以看出,在未转化的酵母细胞中,未检测到HA和Fas的 表达;在转化了pREP3X-HA质粒的酵母细胞中,检测到了 HA的表达,但未检测到Fas的表达;在转化了pREP3X-HAFas 重组质粒的酵母细胞中,既检测到HA的表达,也检测到 了Fas的表达。提示外源基因得到了表达。
2.5 表达产物活性的鉴定重组酵母对照组正常细胞占计 数细胞总数的90.65%,发生了细胞膜泡形成、细胞核碎裂和 细胞核溶解的细胞各占计数细胞总数的2.80%,3.74%和 2.80%;重组酵母处理组细胞正常细胞占计数细胞总数的 37.14%,而发生了细胞膜泡形成、细胞核碎裂和细胞核溶解 的细胞各占计数细胞总数的26.67%、22.86%和13.33%。2 组经χ 2检验,差异有统计学意义(P<0.01)。PI法流式细胞 术凋亡检出率,重组酵母对照组为1.24%,重组酵母处理组 为50.17%,二者差异有统计学意义(P<0.01)。野生型酵母 对照组TUNEL法显微计数凋亡率为9.82%,PI法检出率为 1.32%,与重组酵母对照组比较,差异无统计学意义。
3 讨 论凋亡是一种程序性细胞死亡,对生物体维持内环境稳定 和多细胞生物的生存起重要作用〔8〕。机体在清除自反应免 疫细胞、病毒感染细胞和不可修复的、有恶性转化危险的遗传 损伤细胞时都会发生凋亡。凋亡是一个由许多调节物质和效 应物质组成的复杂网络,可被各种毒素或外来信号(如乙醇、 活性氧自由基(ROS)、各种受体的配体等)、各种细胞内活动 (如有丝分裂缺陷、修复失败)所激活。几乎所有的凋亡过程 在其最后阶段都具有独立的调节通路,凋亡具有典型的生物 化学和形态学标志,这些标志包括含半胱氨酸的天冬氨酸酶 (caspase)激活,膜气泡化,核DNA碎片形成和细胞皱缩〔8〕。 在本研究中PI法凋亡检出率重组酵母处理组为50.17%,低 于TUNEL法。其检出率低的主要原因可能是由于TUNEL法 比较主观,且计数的细胞数只有100个左右,容易产生偏差。 次要原因可能是由于TUNEL法无法很好地鉴定凋亡和坏死,因此可能导致假阳性的产生。比较2种方法的凋亡检出率,差异无统计学意义,说明2.0μmol/L的La(Sal) 2 (Qu)处理6 h后,细胞以凋亡为主,坏死不严重。
| 〔1〕 | Yue Q,Zhou H.Schizosaccharomyces Pombe-a favourable model organism for studying eukaryote[J].Journal of Shaoguan University (Social Science),2003,26:100-103. |
| 〔2〕 | Madeo F,Fr hliche E,Fr hilch KU.A yeast mutant showing diagnostic markers of early and late apoptosis[J].J Cell Biol,1997, 139:729-734. |
| 〔3〕 | 李彦,李旭,张辉,等.稀土药物对大肠杆菌作用的初步研究[J].湘南学院学报:医学版,2008,10(4):19-20,23. |
| 〔4〕 | Kong WJ,Wang Y,Wang Q,et al.Comparison of three methods for isolation of nucleic acids from membranate inner ear tissue of rats[J].Chin Med J(Engl),2006,119:986-990. |
| 〔5〕 | Zhang H,Yu LP,Fang F,et al.Study of the inhibition mechanism of edelfosine on cytokinesis in Schizosaccharomyces pombe[J].Chinese Pharmacological Bulletin,2007,23(3):374-379. |
| 〔6〕 | Sunga M,Hetakeyana T.High efficiency transformation of Schizosaccharomyces pombe pretreated with thiol compounds by electroporation[J].Yeast,2001,18:1015-1021. |
| 〔7〕 | Hou JS,Huang HZ,Wang JG,et al.Effect of fas gene transfection on tumourigenicity and proliferation of transplanted tumor of oral squamous cell carcinoma cell line tca8113[J].West China Journal of Stomatology,2004,22(3):189-191. |
| 〔8〕 | 宋莉,冷传理,宋扬肌.醇六磷酸诱导HT-29细胞凋亡及相关基因表达[J].中国公共卫生,2010,26(4):419-420. |
 2010, Vol. 26
2010, Vol. 26

