2. 辽宁中医药大学职业技术学院;
3. 中国医科大学
有研究表明,瘦素可通过单腺苷酸激活蛋白激酶(adeno-sinemonophosphate-activatedproteinkinase,AMPK)发挥作用。在骨骼肌〔1〕和肝脏〔2〕,瘦素可以刺激脂肪酸氧化,而AMPK的活化起到重要作用。Orci等〔3〕也发现,给小鼠脑脊液中注入瘦素后,其脂肪组织中脂肪酸氧化增加,但这是由于高瘦素血症对脂肪细胞造成的直接效应,还是经由中枢机制仍不十分清楚。本研究拟通过体外分离培养的大鼠脂肪基质细胞成脂诱导分化为脂肪细胞后,采用大鼠重组瘦素处理,检测脂肪细胞内AMPKαl、乙酰辅酶A羧化酶(acyl-CoAcarbo-xylase,ACC)mRNA表达情况,探讨瘦素对大鼠脂肪细胞的脂肪酸合成是否具有直接作用及其可能机制。
1 材料与方法 1.1 材料(1)实验动物:3只Wistar雄性大鼠(中国医科大学实验动物部提供),体重120~140g。(2)主要试剂与仪器:Dulbecco'smodifiedeaglemedia:nutrientmixtureF-12(DMEM/F12)(美国Gibco公司);RNA提取用Trizol试剂(美国Invitrogen公司);逆转录-聚合酶链反应(Reversetran-scriptionpolymerasechainreaction,RT-PCR)试剂盒(TaKaRa大连宝生物公司);液相RNase清除剂(Erasol-2)(绵阳天泽基因公司);大鼠重组瘦素(美国Peprotech公司)。PC812PCR仪(日本ASTEC公司);ECOM-F6124半自动生化分析仪(德国Eppendorf公司)。
1.2 方法 1.2.1 大鼠原代脂肪基质细胞分离培养及成脂诱导分化3只Wistar雄性大鼠,体重120~140g。乙醚麻醉,断头处死,无菌条件下取附睾周围脂肪组织,脂肪基质细胞分离及成脂诱导分化方法参照文献〔4〕。诱导分化10d后,油红O染色鉴定脂肪细胞及计算分化率。
1.2.2 脂肪细胞分组与处理将分化后的脂肪细胞随机分成2组,瘦素处理组加入50nmol/L大鼠重组瘦素,37℃、5%CO2孵育6h,对照组不加任何处理因素。
1.2.3 总RNA提取及 RT-PCR 反应按照Trizol试剂使用说明书提取总RNA,RT-PCR参照文献〔5〕。PCR按如下条件反应:94℃预变性2min;31个循环包括94℃变性30s、50℃退火30s、72℃延伸45s,72℃保持10min。2%琼脂糖电泳检测PCR产物。采用ScionImage4.0.3图像分析软件进行吸光度值测定,统计数据以目的基因与内参基因吸光度值之比表示。
1.2.4 引物AMPK-1上游引物5'-CCTCAGTATTTGAATCCCTC-3',下游引物5'-CCTGGTGGTTTCTGTTGTA3';ACC上游引物5'-GCAGTCTCCCAACTCCTA-3',下游引物5'-CGTTCTACCCAGTCCTTTA-3';GAPDH上游引物5'-AGATCCACAACGGATACATT-3',下游引物5'-TCCCTCAAGATTGTCAGCAA-3'。
1.3 统计分析采用SPSS 11.5软件进行t检验。
2 结 果 2.1 大鼠原代脂肪基质细胞分离培养刚接种的大鼠原代脂肪基质细胞呈圆形或类圆形,胞体透亮,12h后大部分细胞贴壁,72h后细胞充分伸展,呈多角形或梭形,并开始以分散集落方式生长。随着培养时间的增加,细胞变得细长,呈典型的成纤维细胞形,生长比较旺盛,7d左右可长成单层。
2.2 大鼠原代脂肪基质细胞诱导分化细胞长成单层后,经成脂诱导分化剂诱导48h即见细胞变圆,体积增大,胞内有少量脂滴形成。脂滴的数量和体积随诱导时间的延长而增加(图 1),脂滴可被油红O染成红色(图 2),证明诱导所产生的细胞为脂肪细胞。计数分化率约为60%。
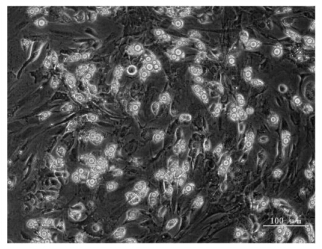 | 图 1 成脂诱导分化图 (10d,100×) |
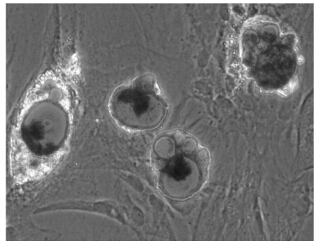 | 图 2 成脂诱导分化 (10d,油红O染色400×) |
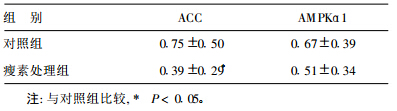
| 表 1 瘦素处理前后脂肪细胞ACC和AMPKα1 mRNA表达 (A值) |
PCR产物经过琼脂糖凝胶电泳后显示,瘦素处理组ACC表达明显降低,而AMPKα1的表达与对照组比较则无明显变化。吸光度值分析结果表明,瘦素处理组大鼠脂肪细胞的ACCmRNA表达水平明显低于对照组,差异有统计学意义(P<0.05),而AMPKα1mRNA的表达则无明显差异(P>0.05)。
3 讨 论用脂肪基质细胞诱导分化为脂肪细胞来进行实验,是在研究脂肪细胞的分化、代谢等方面被广泛采用的一种方法〔6〕。本研究结果表明,通过成脂诱导分化剂的刺激,原代大鼠脂肪基质细胞可较高水平地分化为脂肪细胞,为后续实验奠定基础。ACC是脂肪酸合成的限速酶,也是AMPK的一个重要底物。研究表明,ACC1特异性敲除小鼠脂肪组织脂类储存减少〔7〕。瘦素缺陷小鼠ACCmRNA的表达增强,可导致脂肪酸合成增加,而给予瘦素干预后,ACCmRNA的表达下调〔8〕。瘦素处理后大鼠脂肪细胞中ACCmRNA表达降低,提示瘦素可以促进体外培养的脂肪细胞脂肪酸合成降低,进而使脂肪细胞内脂肪合成减少。
在脂肪组织中,AMPKαl分布较为广泛,是AMPK活性的主要组成部分〔9, 10〕。本研究瘦素处理组的AMPKαlmRNA表达与对照组比较,并未明显增加,提示在体外培养的脂肪细胞中,瘦素发挥抑制脂肪合成、促进脂肪酸分解的作用可能并非通过激活AMPKαl而是通过激活AMPKα2,进而使ACC磷酸化而失活或通过其他瘦素信号转导途径,如Jak-STAT通路等起作用。进一步研究需检测AMPKα2mRNA、磷酸化AMPK蛋白表达及其活性。
| 〔1〕 | Tanaka T,Hidaka S,MasuzakiH,et al.Skeletal muscle AMP activated protein kinase phosphory lation parallels metabolic phenotype in lept in transgenicmice under dietary modification[J].Diabetes,2005,54(8):2365-2374. |
| 〔2〕 | A ssifi MM,Suchankova G,Constant S,et al.AMP activated protein kin se and coordination of hepatic fatty acid metabolism of starved/carbohyd rate refed rats[J].Am J Physiol,2005,289(5):E794E800. |
| 〔3〕 | OrciL,CookW S,Ravazzola M,et al.Rapid transformation of white adipocytes in to fatoxidizing m achines[J].Proc Natl Acad Sci USA,2004,101(7):2058-2063. |
| 〔4〕 | GuH,L iu L,M a S,et al.Inhibition of SOCS 3 in adipocytes of rats with diet induced obesity increases lept in mediated fatty acid oxidation[J].Endocrine,2009,36(3):546-554. |
| 〔5〕 | 刘莉,马爽,李岩溪,等.高脂饮食大鼠脂肪组织SOCS3及FAS表达[J].中国公共卫生,2009,25(4):428-430. |
| 〔6〕 | 刘相名,杨立业,苗宏生,等.脂肪组织来源的多能干细胞培养和外源基因的表达[J].中华实验外科杂志,2003,20(2):162-164. |
| 〔7〕 | Mao J,Yang T,Gu Z,et al.AP2 Cre mediated inactivation of acetyl Co A carboxy lase 1 causes growth retardation and reduced lipid accumulation in adipose tissues[J].Proc Natl Acad Sci USA,2009,106(41):17576-17581. |
| 〔8〕 | Li J,Grigoryev DN,Ye SQ,et al.Chronicinterm ittent hypoxia up regulates genes of lipid biosynthes is in obese mice[J].Appl Physiol,2005,99(5):1643-1648. |
| 〔9〕 | Lihn AS,Jessen N,Pedersen SB,et al.AICAR stimulates adiponect in and inhibits cytok ines in adipose tissue[J].B iochem Biophys Res Commun,2004,316(3):853-858. |
| 〔10〕 | Daval M,DiotDupuy F,Bazin R,et al.Anti lipolytic action of AM Pactivated protein kinase in rodent ad ipocytes[J].J BiolChem,2005,280(26):25250-25257. |
 2010, Vol. 26
2010, Vol. 26