2. 贵阳医学院人体寄生虫教研室
真核翻译起始因子(ELFs)参与蛋白质合成途径,其亚单位EIFs3是至今为止了解最少而又最为复杂的一种起始因子,至今,对该亚单位的研究成果除已知其参与真核翻译起始进程之外,还参与细胞生长和细胞周期的调控〔1, 2〕。为此,本研究在课题组构建的亚洲带绦虫成虫全长cDNA文库中找到EIFs3基因并对其进行原核构建及免疫学初步分析,为进一步研究该因子在带绦虫生命周期的影响奠定基础。
1 材料与方法 1.1 材料 1.1.1 感染血清、文库、质粒和菌株血清取自贵州省都匀市从江县亚洲带绦虫、猪带绦虫及牛带绦虫粪检阳性的带绦虫患者。亚洲带绦虫成虫全长cDNA质粒文库的构建、同源表达序列标志(EST)测序及Unigene分析与上海联合基因有限公司合作完成。原核表达质粒pET-28a(+)及大肠埃希菌BL-21/DE3(中山大学热带病防治教育部重点实验室保存)。
1.1.2 主要试剂和工具酶高效PCR扩增DNA多聚酶(EXTaq)(含dNTP),BamH1,XhoⅠ,T4DNA连接酶,DNA标准(DL15000;DL2000)(大连宝生物工程公司);异丙硫代-β-D半乳糖苷(IPTG)(美国Promega公司);Ni-IDAAgarose(catNo:69670)(美国Novagen公司);蛋白分子量标准(立陶宛MBI公司);DNA凝胶回收试剂盒(中国铂尔尔生物科技公司);质粒纯化试剂盒(广州东盛科技公司);辣根过氧化物酶标记的山羊抗猪IgG二抗,兔抗人二抗,3,3二氨基联苯胺(DAB)显色试剂盒(武汉博士德生物工程有限公司);丙烯酰胺、尿素(上海MBCHEM公司);氯化钙、氯化钠等试剂(国产分析纯)。
1.2 方法 1.2.1 ELFs3基因的识别与扩增亚洲带绦虫成虫cDNA质粒文库参照文献〔3〕构建。将获得的亚洲带绦虫unigene进行Blastx分析,克隆号为TaHC23-E3的序列是EIFs3的同源基因,根据已获得的ELFs3基因全长编码序列的开放阅读框,利用DNAClub和PCRdesign软件设计引物:上游引物:5'-CCCGAATTCATGAGTGATTGGGATGC-3'带EcoRⅠ酶切位点,下游引物:5'-ATTGCGGCCGCTTAATCGTAGTCG-3'带NotⅠ酶切位点。以文库中编号为TaHC23-E3的质粒为模板进行聚合酶链反应(polymerasechainreactiom,PCR)扩增目的基因。PCR产物用0.8g/L琼脂糖凝胶电泳鉴定回收。
1.2.2 重组原核表达质粒的构建及鉴定PCR产物和pET-28a(+)载体分别用EcoR1和NotⅠ双酶切,回收、连接后转入大肠埃希菌BL-21/DE3感受态细胞,卡拉霉素筛选阳性克隆,对阳性克隆依次进行质粒的提取,双酶切和PCR鉴定。
1.2.3 重组蛋白的诱导表达取培养过夜的阳性克隆菌液,加入含有卡那霉素的培养基中中,37℃250r/min振摇至A600=0.4~0.6,加入异丙基硫代-β-D半乳糖苷(IPTG)至终浓度1mmol/L诱导表达5h。用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白质的表达。同时设pET-28a(+)质粒的诱导前后及重组质粒的诱导前作对照。
1.2.4 EIFs3基因在大肠埃希菌BL-21/DE3中的表达依据上述诱导表达方法对阳性克隆进行大量的诱导表达。用基础液重悬离心收集菌体并冰上放置超声裂解细菌,收集上清和沉淀行SDS-PAGE判断重组蛋白的可溶性。将样品加入预先处理好的镍离子交换树脂亲和层析纯化柱中,最后再用磷酸盐缓冲液(PBS)透析以去掉过柱时留下的咪唑。
1.2.5 蛋白质印迹 (Western blotting )分析将纯化好的蛋白用10%的分离胶进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),使用电转印仪于冰上转膜(100V,1h),将凝胶上的蛋白转移到聚偏二氟乙烯(PVDF)膜,牛血清白蛋白(BSA)室温封闭2h;再与亚带、牛带、猪带绦虫患者及正常人血清(按1:400稀释)结合,4℃孵育过夜;次日,PBS洗3次,然后与辣根过氧化物酶(HRP)标记的兔抗人IgG(按1:2000稀释)室温孵育1h,PBS洗3次;最后3,3二氨基联苯胺(DAB)显色至出现目的条带,超纯水终止反应。
2 结 果 2.1 EIFs3基因的识别和序列分析该序列推导的氨基酸序列与GenBank中猪带绦虫EIFs3同源性分值最高,一致性达到58%,该基因全长1176bp,编码区为:69~588bp,编码173个氨基酸。其最大ORF为其完整编码区。该蛋白无跨膜区,不具有分泌性信号肽,未发现线粒体、过氧化酶体、溶酶体、质体和细胞核等亚细胞定位序列〔4〕。
2.2 原核重组质粒的鉴定将重组质粒进行PCR和双酶切鉴定,产物行0.8g/L琼脂糖凝胶电泳。结果显示在600bp左右有一清晰条带,与目的基因大小基本相符,此外重组质粒的测序报告表明插入序列与理论序列一致,证明重组质粒构建成功。
2.3 蛋白表达纯化结果 (图 1)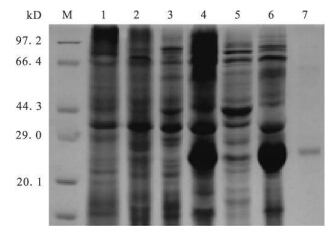 | 注:M:蛋白Marker;1:pET-28a(+)未诱;2:pET-28a(+)诱导;3:pET-28a(+)-EIFs3未诱;4:pET-28a(+)-EIFs3诱导;5:pET-28a(+)-EIFs3上清;6:pET-28a(+)-EIFs3沉淀;7:pET-28a(+)-EIFs3纯化蛋白。 图 1 10g/LSDS-PAGE分析pET-28a(+)- TaAnnexins B3在大肠埃希菌中的表达产物及其纯化产物 |
将构建好的重组质粒转化到E.coliBL/DE3中表达,超声裂解后SDS-PAGE电泳分析,结果第6泳道所示,在大约26kD处出现高效表达条带,与目的蛋白基本相符。通过破包涵体,将蛋白进行纯化,结果如图中第7泳道所示,其位置与目的蛋白相符,证明目的蛋白纯化成功。
2.4 纯化蛋白免疫反应性 (Westernblotting鉴定) (图 2)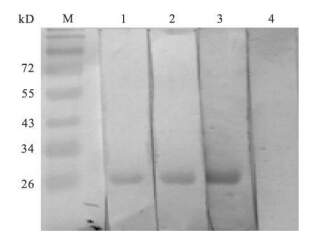 | 注:M:蛋白Marker;1:亚洲带绦虫患者血清;2:牛带绦虫患者血清;3:猪带患者血清;4:正常人血清。 图 2 重组蛋白的Western blotting鉴定 |
用感染亚洲带绦虫、猪带绦虫的患者血清以及感染牛带绦虫的患者血清对纯化蛋白的WesternBlotting结果均显示出较清晰的条带(图中第1,2,3泳道),而阴性对照血清(图中第4泳道)在相应位置未识别出该蛋白条带。
3 讨 论作为亚太地区带绦虫的优势虫种〔5〕,亚洲带绦虫与牛带绦虫由于流行模式的不同,可引起一些不食或少食牛肉的国家和地区的流行,对劳动生产力和畜产品破坏极大。课题组多年对亚洲带绦虫功能基因组学进行研究〔6, 7, 8, 9〕,以期筛选出该虫生命周期起关键作用的基因作为疫苗的候选分子或药物靶标,从而找到带绦虫病的有效防治方法。
本研究将EIFs3的编码序列克隆入原核表达质粒pET-28a(+)中,成功构建原核表达载体,并转入大肠埃希BL21/DE3中诱导表达,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析结果所示,大约在26kD左右处出现表达条带,与前期通过生物信息学预测的蛋白分子量基本相符,表明EIFs3在大肠埃希菌种得到了高效表达且目的蛋白纯化成功。在真核细胞翻译起始中,EIFs3是与其他翻译起始因子相互联系的中心蛋白因子,通过与其他EIFs3相互作用,促进三元起始复合物与40S亚基结合并识别正确的起始AUG密码子,并在蛋白质翻译起始的特殊阶段和翻译过程中通过蛋白激酶来调控蛋白质合成,该基因在细胞生长、癌症、细胞凋亡等方面都具有重要作用〔10, 11, 12〕。
| 〔1〕 | Alan G.EIFs3:a versatile scaffold for translation initiation complexes[J].Trends in Biochemical Sciences,2006,31(10):553-562. |
| 〔2〕 | Zhang L,Pan X,Hershey JW.Individual overexpression of five subunits of human translation in itiation factore IF3 promotes malignant transformation of mimortal fibroblast cells[J].J Biol Chem,2007,282(8):5790-5800. |
| 〔3〕 | 黄江,胡旭初,包怀恩,等.亚洲带绦虫成虫全长cDNA质粒文库的构建及EST测序[J].热带医学杂志,2007,7(2):116-118. |
| 〔4〕 | 尚丹,国强华,景霞.常用医学生物信息学[M].北京大学医学出版社,2003:148-258. |
| 〔5〕 | 包怀恩.我国亚洲牛带绦虫研究的现状和展望[J].热带医学杂志,2002,2(3):215-219. |
| 〔6〕 | 廖兴江,戴佳琳,黄江,等.亚洲牛带绦虫泛素缀合酶E2的克隆表达及免疫鉴定[J].西安交通大学学报,2009,30(4):395-398. |
| 〔7〕 | 戴佳琳,黄江,廖兴江,等.猪带绦虫腺苷酸激酶基因及其蛋白结构特性分析[J].中国公共卫生,2009,25(10):1214-1215. |
| 〔8〕 | 廖兴江,戴佳琳,周灵贵,等.亚洲牛带绦虫泛素缀合酶基因及其蛋白质结构与功能的生物信息学分析[J].中国人兽共同患病杂志,2009,25(3):234-237. |
| 〔9〕 | 戴鹏,戴佳琳,黄江,等.亚洲牛带绦虫TaCR ISP基因克隆,表达和序列分析[J].中国公共卫生,2009,25(4):398-400. |
| 〔10〕 | Shi J,K ahle A,Hershey JW,et al.Decreased expression of eukaryotic initiation factor 3 deregu lates translation and apoptos is in tumor cells[J].On cogene,2006,25(35):4923-4936. |
| 〔11〕 | 沈杰,李慧华,张建亭,等.EIF3S 10在肺癌组织中的表达及与化疗反应的关系[J].国际病理科学与临床杂志,2006,26(5):369-371. |
| 〔12〕 | MayeurGL,HersHJ.M alignant transformation by the eukaryotictran slat ion in itiation factor 3 subun it p48(eIF3 e)[J].FEBS Lett,2002,514(1):49-54. |
 2010, Vol. 26
2010, Vol. 26

 , 廖兴江2, 李波2, 王宇2, 江楠3
, 廖兴江2, 李波2, 王宇2, 江楠3