2. 天津市疾病预防控制中心
维生素E包括生育酚和生育三烯酚2个亚族,每一亚族又各有α-、β-、γ-和δ-4种亚型。研究表明,生育三烯酚不仅具有抗氧化、抗生物膜脂质过氧化作用,还具有降低胆固醇〔1〕、保护神经〔2〕、阻滞细胞周期〔3〕、激活p53〔4〕、抑制分子间粘附及下调末端转移酶端粒〔5〕。Wada等〔3〕研究了4种生育三烯酚亚型对人肝癌细胞HepG2的抑制作用。结果显示,δ-生育三烯酚在人肝癌细胞HepG2中具有更大的抗增殖能力。本研究通过体外培养人结肠癌SW620细胞,观察δ-生育三烯酚对人结肠癌细胞增殖抑制作用及抗肿瘤作用机制。
1 材料与方法 1.1 试剂和仪器纯度为97%的δ-生育三烯酚(新加坡Davoslife公司);Trizol提取液及L-15培养基(美国Gibco公司);反转录试剂盒(美国Invitrogen公司);含SYBRGreenI的PCRMasterMix、Bio-RadIQ5实时PCR检测系统(美国Bio-Rad公司)。
1.2 细胞培养SW620细胞(中国科学院上海细胞生物学研究所);培养于含体积分数为1%的青链霉素、1%谷氨酰胺和10%胎牛血清L-15培养液中;于5%CO2,37℃恒温培养箱中培养;用0.25%的胰酶进行消化、传代。
1.3 分组与给药将δ-生育三烯酚溶于无水乙醇中。细胞增殖试验,给予δ-生育三烯酚剂量为0,5,10,15,20,30,40,50和60mol/L;mRNA检测给予δ-生育三烯酚剂量为0,20,30,40和60μmol/L,每个浓度设3个平行样。阴性对照组为无水乙醇,终浓度为0.15%(V/V)。
1.4 四甲基偶氮噻唑蓝 (MTT)法检测细胞增值每孔1×104个细胞接种到96孔板,每孔体积200L。培养24h后,换成含不同剂量δ-生育三烯酚的完全培养液,继续培养24h。加入新鲜配制的MTT(5mg/mL)20μL,继续培养4h。吸弃上清液。每孔加200μL二甲基亚砜(DMSO),振荡10min。酶标仪于492nm波长检测吸光度(A)值,计算生存率。
1.5 Real-time RT-PCR按照试剂说明书进行总RNA提取。每个样品取5μg总RNA逆转录成cDNA。反应条件:50℃,50min;85℃,5s。取1.2μLcDNA加1.5UTaq聚合酶及相应缓冲液于25μL体系内进行PCR扩增。引物序列及产物分别为:结肠癌腺瘤性息肉蛋白(APC)上游5'-ATTCCATGCGTTGGCACTTAT-3',下游5''-GCCTCGAAGAGACTGCAATGT-3',扩增片段为258bp;丝/苏氨酸磷酸激酶(GSK-3β)上游5'-CGTGACCAGTGTTGCTGAGTG-3',下游5'-GACCATGTTGCGTCATCATCA-3',下游5'-AAGCACAGCGGCAGTGATTC-3'扩增片段为183bp。PCR反应条件如下:95℃,120s,40个循环;95℃,10s;60℃,30s。每个剂量设3个平行样。基因相对表达量的计算按照文献〔6〕。
1.6 统计分析采用SPSS 15.0软件进行单因素方差分析,两两比较用Dunnett-t检验。检验水准α=0.05。
2 结 果 2.1 δ-生育三烯酚对SW620细胞的生长抑制作用(图 1)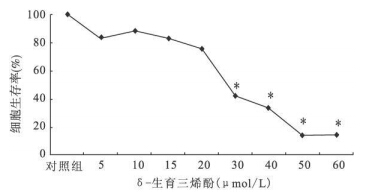 | 注: 与对照组比较, *P < 0.05。 图 1 不同剂量δ-生育三烯酚对细胞增殖的影响 |
结果显示,δ-生育三烯酚能够明显抑制SW620细胞的生长。作用24h时,由低到高剂量组细胞存活率分别为83.2%,88.8%,82.9%,76.1%,42.1%,33.9%,14.8%和14.4%。>30mol/L各剂量组细胞存活率与对照组比较差异均有统计学意义(P<0.01)。
2.2 δ-生育三烯酚对GSK-3β、APC及AxinmRNA表达影响(表 1)| 表 1 不同组别GSK-3β、Axin和APCmRNA表达水平 (n = 3, x ± s) |
与乙醇对照组比较,GSK-3βmRNA与APCmRNA的表达差异无统计学意义(P>0.05)。而AxinmRNA的各组表达与对照组比较差异有统计学意义(F=6.598,P<0.05)。
3 讨 论由Axin、APC和GSK-3β共同组成“降解复合体”,起到负向调节Wnt信号通路的作用。在此复合体中,Axin起到支架作用,即Axin吸收途径的大部分组分,通过将酶(GSK-3β和CKI)和底物(β-catenin)结合,促进GSK-3β对β-catenin丝氨酸/苏氨酸残基磷酸化,使得β-catenin最终被泛素-蛋白酶体降解。Axin同时也与肿瘤抑制蛋白APC相连接〔7〕。APC-Axin复合体可调节丝氨酸/苏氨酸激酶GSK-3β的活性,并且GSK-3β催化β-catenin的作用还必须在Axin结合位点的参与下进行〔8〕。本研究结果表明,在δ-生育三烯酚的作用下AxinmRNA表达增加,使得Wnt信号通路水平下降引起细胞增殖抑制。同时δ-生育三烯酚对APC及GSK-3β的基因表达无明显影响,提示这2个基因不是δ-生育三烯酚的作用靶点。因此,δ-生育三烯酚拮抗结肠癌可能是通过对其结肠癌细胞中AxinmRNA水平调控来实现。δ-生育三烯酚对肿瘤细胞的增殖抑制作用,其机制可能与诱导AxinmRNA表达增加有关。
| 〔1〕 | Qureshi AA,Sami SA,S alserW A,et al.Dose dependent suppression of serum cholesterol by tocotrienol rich fraction(TR F25)of rice bran in hypercho lesterolemic humans[J].A therosclerosis,2002,161:199-207. |
| 〔2〕 | Khanna S,Roy S,Ryu H,et al.Molecular basis of vitam in Eaction:tocotrienol modu lates 12-lipoxygenase,a key mediator of glutamate induced neurodegeneration[J].J Biol Chem,2003,278:43508-43515. |
| 〔3〕 | Wada S,Satomi Y,urakosh iM,et al.Tumor suppressive effects of tocotrienol in vivo and in vitro[J].Cancer Lett,2005,229:181-191. |
| 〔4〕 | A garwal M K,A garwal M L,A thar M,et al.Tocotrienolrich fraction of palmoil activates p53,modulates Bax/Bcl2 ratio and induces apoptos is independent of cell cycle association[J].C ell Cycle,2004,3:205-211. |
| 〔5〕 | Eitsuka T,Nakagaw a K,Miyazawa T.Down regulation of telomerase activity in DLD 1 human colorectal adenocarcinom a cells by tocot rienol[J].Biochem Biophys Res Commun,2006,348:170-175. |
| 〔6〕 | Haydon PG.GLIA:listening and talking to the synapse[J].Nat Rev Neurosc,i 2001,2(3):185-193. |
| 〔7〕 | Wiechens N,Heinle K,Engmleier L,et al.Nucleo cytop lasmic shuttling of axin,an egative regulator of the Wnt-β-catenin pathway[J].J Biol Chem,2004,279(7):5263-5267. |
| 〔8〕 | Hart M J,delos Santos R,Albert IN,et al.Down regulation of betacaten in by human A xin and its association with the APC tumorsu pressor,betacaten in and GSK-3β beta[J].Curr Biol,1998,8(10):573-581. |
 2010, Vol. 26
2010, Vol. 26

