研究表明,泌尿系统细菌感染是引起男性不育的重要原因,其中,大肠埃希菌、表皮葡萄球菌、草绿色链球菌是男性不育患者精液中3种常见细菌,男性泌尿生殖道细菌感染中大肠埃希菌分离率约66%〔1〕。细菌培养法、生化反应鉴定法是泌尿系细菌感染检测常用方法,特异性较好,但存在费时、细菌交叉反应出现假阳性等问题〔2〕。为快速准确诊断男性泌尿系细菌感染,本研究采用多重PCR技术,同时检测大肠埃希菌、表皮葡萄球菌、草绿色链球菌,并通过优化引物和反应条件,建立了同时检测这3种常见泌尿系感染细菌的方法,为病原体感染致男性不育的临床诊断提供快速、灵敏、准确、廉价的检测平台。现将结果报告如下。
1 材料与方法 1.1 材料(1)菌株:实验菌株5株,包括:大肠埃希菌JM109,金黄色葡萄球菌(本室保藏);草绿色链球菌,表皮葡萄球菌,大肠埃希菌O6(山东省疾病控制与预防中心)。除草绿色链球菌用血清肉汤培养基外,其他菌株均用营养肉汤培养基,37℃培养18 h,转接3次后备用。(2)主要试剂与仪器:TaqDNA聚合酶,10×buffer (大连宝生物工程有限公司),DNA mark-D (加拿大Bio Basic公司);脱氧核苷三磷酸(d NTP),琼脂糖(上海生工公司);溴化乙锭(EB),十二烷基磺酸钠(SDS),蛋白酶K,溶菌酶(美国Sigma公司);常规试剂为国产分析纯试剂。凝胶成像分析系统,PCR仪,核酸电泳仪,核酸蛋白分析仪(美国Biorad公司);BP310S型电子天平(德国Sartorius公司);DSH 系列超净工作台(上海淀山湖净化设备厂);PH SJ3F型实验室pH计(上海精密科学仪器有限公司)。
1.2 方法 1.2.1 引物设计与合成参照文献〔3, 4, 5〕,分别根据大肠埃希菌O6编码其O抗原多聚酶基因rfc基因、草绿色链球菌rnpB基因和表皮葡萄球菌ica基因设计3对引物(上海生工生物工程技术服务有限公司合成)。(1)草绿色链球菌:rnpB F:5'-Y (C/T)GTGCAATTTTTGGATAAT-3',R:5'-TTCTATAAGCCATGTTTTGT-3',373 bp;(2)大肠埃希菌O6:rfc F:5'-GTTTCTTGTATTCAGTATGCT-3',R:5'-TGGGTTTGCTGTGTATGAGGC-3',1 115 bp;(3)表皮葡萄球菌:ica F:5'-TTATCAATGCCGCAGTTGTC-3',R:5'-GTTTAACGCGAGTGCGCT AT-3',546 bp。
1.2.2 细菌DNA提取制备将菌株分别接种相应液体培养基中,260 r/min 37℃振荡培养过夜。测定吸光度值(A),当A600nm为0.6时,取菌液培养物1.5 mL置于离心管,5 000 r/min,离心10 min后弃上清,收集菌体备用。应用改良十六烷基三甲基溴化铵/氯化钠(CTAB/NaC l)法提取细菌DNA,-20℃保存备用。
1.2.3 多重PCR反应体系优化以3种细菌的混合DNA为扩增模板,对多重PCR反应条件进行优化。初始反应条件为:反应体系25μL,包括25 mmol/L Mg2+2.5μL,10×buffer 2.5μL,10 mmol/L dNTP 0.2μL,10 mmol/L引物0.2μL,5U/L Taq酶0.2μL;反应条件:94℃预变性4 min后;94℃30 s,52℃30 s,72℃1 min,35个循环;然后72℃4 min。完成后取10μL PCR产物在1.5%琼脂糖凝胶(含溴化乙锭)中100 V电泳30 min,用凝胶成像系统观察分析结果。然后对PCR反应影响较大的Mg2+浓度、引物浓度、PCR反应退火温度进行优化。
1.2.4 特异性测定利用所选择的最佳反应条件,对所有菌株进行多重PCR检测,电泳分析PCR结果,以检测该方法特异性。
1.2.5 灵敏度测定对3种细菌DNA进行紫外分光浓度测定,然后分别作1:10梯度稀释。吸取每一稀释度混合DNA一起进行多重PCR反应,电泳分析结果,以检测其敏感性。
2 结 果 2.1 细菌DNA提取的优化对CTAB/NaCl法进行改良,建立提取表皮葡萄球菌和草绿色链球菌等革兰阳性菌DNA的最优方案:加入50μL 1×Tris•HCl乙二胺四乙酸(EDTA)缓冲液,重悬菌体沉淀;加入溶菌酶12.5μL,37℃孵育30 min,后加入10% SDS 30μL和10 mg/mL蛋白酶K 6μL,混匀,37℃孵育1 h;加入5 mol/L NaCl 100μL,充分混匀后再加入80μL CTAB/NaCl混匀,65℃孵育10 min;加入等体积酚/氯仿/异戊醇,混匀,10 000 r/min离心5 min,上清移至一新管,加入0.6倍体积的异戊醇,10 000 r/min离心5 min,收集DNA后70%乙醇洗涤,提取革兰阳性细菌DNA凝胶电泳结果。
2.2 多重PCR反应体系优化多重PCR扩增最佳反应条件(25μL):25 mmol/LMg2+2.5μL,10×buffer 2.5μL,10 mmol/L dNTP 0.6μL、3对10 mmol/L引物各0.5μL,5U/L Taq酶0.4μL,3种细菌DNA模板各1μL。扩增反应条件:94℃预变性4 m in;94℃变性45 s,49℃退火45 s,72℃延伸90 s,共35个循环,72℃延伸5 m in,4℃保存。
2.3 优化后3种细菌多重PCR检测特异性(图 1)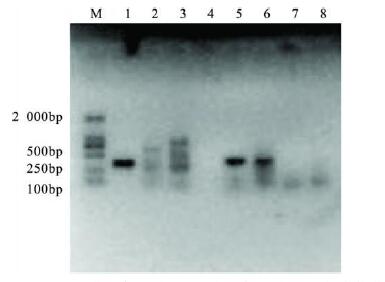 |
注: M: marker; 1: 草绿色链球菌; 2: 草绿色链球菌和表皮葡萄球 菌; 3: 草绿色链球菌、表皮葡萄球菌和大肠埃希菌O6; 4: 金黄色葡萄 球菌和大肠埃希菌JM109; 5: 草绿色链球菌和金黄色葡萄球菌; 6: 草 绿色链球菌和大肠埃希菌JM109; 7: 阴性对照; 8: 空白对照 图 1 多重PCR 反应体系优化后3种细菌特异性测定 |
图 1可见,优化后的检测体系对草绿色链球菌,表皮葡萄球菌,大肠埃希菌O6可特异性检出,其扩增片断分别是373 bp,546 bp和1 115 bp。
2.4 优化后3种细菌多重PCR检测灵敏度(图 2)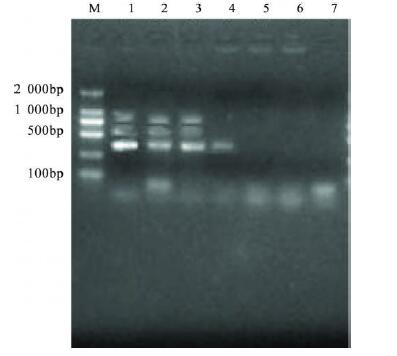 |
注: M: marker; 1: 草绿色链球菌( 2.076×105 m g /L) 表皮葡萄球 菌( 2.99×106 m g /L)大肠埃希菌O6 ( 1.81×106 mg /L ) ; 2: 草绿色链 球菌( 2.076×104 m g/L)表皮葡萄球菌( 2.99×105m g /L)大肠埃希菌 O6( 1.81×105 mg /L ); 3: 草绿色链球菌( 2.076×103 m g /L)表皮葡萄 球菌( 2.99×104 m g /L)大肠埃希菌O6 ( 1.81×104 m g/L) ; 4: 草绿色 链球菌( 2.076×102 m g/L)表皮葡萄球菌( 2.99×103m g /L)大肠埃希 菌O6( 1.81×103 mg /L) ; 5: 草绿色链球菌( 2.076×10 m g /L)表皮葡 萄球菌( 2.99×102 m g /L)大肠埃希菌O6( 1.81×102 m g /L) ; 6: 阴性 对照; 7: 空白对照 图 2 多重PCR 优化体系检测3种细菌的灵敏度 |
应用紫外分光光度法测定3种细菌DNA原液浓度分别为:草绿色链球菌2.076×106 mg/L,表皮葡萄球菌2.99×107 mg/L,大肠埃希菌1.81×107 mg/L。分别作1:10梯度稀释后进行多重PCR检测。图 2可见:草绿色链球菌在1:104,表皮葡萄球菌和大肠埃希菌在1:103稀释浓度时有较暗条带,表明在3种细菌同时存在的体系中,多重PCR检测灵敏度分别为草绿色链球菌2.076×102 mg/L,表皮葡萄球菌2.99×104 m g/L,大肠埃希菌1.81×104 mg/L。
3 讨 论目前检测泌尿系病原细菌的常规培养方法,通常需经富集培养、形态观察、生理生化鉴定等过程,一般需4~7 d,操作繁琐,费时耗力;乳胶凝集法、免疫磁珠分离法、酶免疫测定方法、核酸杂交技术和PCR技术因其特异性强、敏感性高、操作简单快速而得到广泛应用〔6〕,但通常只能检测1种病原体。本研究建立的多重PCR方法克服以上不足,可在4 h左右通过1次实验完成大肠埃希菌、草绿色链球菌和表皮葡萄球菌的同时检测,有较好的特异性和敏感性,比传统的细菌学方法简便经济,有较大的应用价值。
由于革兰阳性菌具有特殊的细胞壁结构,我们对革兰阳性菌全基因组DNA提取方法进行了改良,可以在2 h内完成表皮葡萄球菌、草绿色链球菌全基因组的提取,与常规碱裂解法、煮沸法相比,快速、简洁、有效,适用于葡萄球菌、链球菌和其他革兰阳性病原细菌DNA提取。多重PCR反应体系中存在多对引物和多个模板,相互之间发生交叉作用的几率增加。本研究选用目标菌高度保守的序列,确保不同引物对之间没有同源性或互补性,扩增片段能通过电泳区分开。同时,本实验选取对扩增效率影响较大的退火温度、Mg2+浓度、引物浓度3个重要参数进行优化研究,获得了较好的灵敏度结果。本研究建立的多重PCR方法,可以简便、快速、灵敏地同时检测大肠埃希菌、草绿色链球菌和表皮葡萄球菌,在核酸分子检测水平方面为临床诊断提供了有效手段,为公共卫生、流行病学检测提供了一种新思路、新方法。
| 〔1〕 | Pellati D,Mylonakis,IBertoloni G,et al. Genitaltract infections and in fertility[J].Eur J Obstet Gynecol Reprod Biol, 2008,140(1):3-11. |
| 〔2〕 | 李波,王春香,陈林娜,等.泌尿道感染病原菌对多类抗生素耐药性相关分析[J].中国公共卫生,2008,24(5):597-599. |
| 〔3〕 | Grozdanov L,ZhringerU,Blum OehlerG,et al. Asingle nucleotide exchange in the wzygene is responsible for the semirough O6 lipopolysaccharide phenotype and serumsen sitivity of Escherichia coli strain Nissle 1917[J].J Bacteriol, 2002,184(21):5912-5925. |
| 〔4〕 | Tapp J,Thollesson M,B Herrmann.Phylogenetic relationships and genotyping of the Streptococcus genus by sequence determination of the RN ase PRNA genernp,B[J].Int J Syst Evol Microbiol, 2003,53(6):1861-1871. |
| 〔5〕 | Huwe P,Diemer T,Ludwig M,et al. Influence of different uropathogenic microorganisms on human sperm motility parameters in an in vitro expermient[J].And rologia,1998,30(suppl):55-59. |
| 〔6〕 | 王丽,李琳,石磊.食源沙门菌DNA环介导恒温核酸扩增法检测[J].中国公共卫生,2009,25(2):255-256. |
 2010, Vol. 26
2010, Vol. 26

