2. 新疆医科大学第一附属医院
蔷薇系蔷薇属(Rosa L,RL)植物的总称,全世界蔷薇属种类约有200种,广泛分布在北半球的亚洲、欧洲、非洲北部及北美洲的寒温带至亚热带地区。中国蔷薇属植物82种,约占世界种类的41%,居世界首位;新疆蔷薇属植物种类27种,引进栽培种11种,野生种16种,变种12种,变型3种,约占全国蔷薇植物总数32.9%。野蔷薇抗诱变及抗肿瘤作用已有报道〔1, 2〕,本实验研究其抗肿瘤作用,为其开发利用提供科学依据。
1 材料与方法 1.1 提取物制备取采自新疆额敏县新鲜野蔷薇果若干,粉碎,加入50%乙醇溶液适量,体积比约为1:2。热水浴 (50℃)提取3次,每次2 h;合并3次提取液,过滤,水浴 (50℃)浓缩并回收乙醇至浸膏,置冰箱备用。
1.2 细胞株和实验动物人宫颈癌细胞株(Hela)、人乳腺癌细胞株(Bcap-37)、人卵巢癌细胞株(HO8910)、人膀胱癌细胞株(T24)(中国科学院上海细胞生物研究所细胞库)。昆明种小鼠(新疆医科大学实验动物中心),体重18~25 g,雌性,合格证:医动字第16-003号。
1.3 主要试剂与仪器Bio-Rad550酶标仪(上海Bio-Rad公司),JEM-1200EX透射电镜(日本JEOL公司);RPM1640(美国Gibco公司);新生牛血清(杭州四季青公司),胰蛋白酶、碘化丙啶(美国Sigma公司);顺铂(山东齐鲁制剂厂);兔抗- bax多克隆抗体、兔抗-bcl-2多克隆抗体、兔抗-caspase-3多克隆抗体(美国Santacruz公司)。
1.4 实验方法 1.4.1 体外抗肿瘤实验实验分为野蔷薇果提取物100,10,1,0.1 mg/mL 4个浓度、阴性对照(含同一细胞密度的培养液)、阳性对照(顺铂10 μg/mL)。对数生长期细胞(细胞为5 × 105/mL)100 μL接种于96孔板,37℃饱和湿度,5%、 CO2条件下,培养4 h,待细胞贴壁,加入100 μL不同剂量受试物,每组5孔。分别在24,48,72 h取出96孔板,加四甲基偶氮噻唑蓝(MTT)溶液(5 mg/mL)20 μL,37℃继续孵育4 h,吸弃孔内培养液。每孔加入150 μL二甲基亚砜,振荡10 min,在酶标仪578 nm处测定各孔吸光度(A值)。肿瘤细胞生长抑制率=(对照组A值-实验组A值)/对照组A值× 100%。
1.4.2 体内抗肿瘤实验40只昆明小鼠随机分为4组:模型对照,野蔷薇果提取物高、中、低剂量组,分别给予野蔷薇果提取物2 000,1 000,500 mg/(kg·wb)。依照文献〔3〕方法制备移植S180腹水瘤和实体瘤模型,每只小鼠腹腔注射0.2 mL腹水。注射第2 d开始灌胃给予不同剂量提取物,模型对照给予同体积蒸馏水,S180腹水瘤试验干预时间直至小鼠死亡为止,记录小鼠死亡时间,根据公式计算生命延长率 (ILS):ILS=(实验组平均存活天数/对照组平均存活天数- 1)× 100%。S180实体瘤干预时间为2周。每7 d小鼠称重 1次,干预结束后剥离肿瘤称重,计算肿瘤生长抑制率(IR): IR (%)=(阴性对照组平均瘤重-治疗组平均数瘤重)/阴性对照组平均瘤重× 100%。
1.4.3 细胞凋亡检测用野蔷薇果提取物(终浓度为0.05 g/mL)干预培养4株肿瘤细胞,48 h后,依据试剂盒使用说明进行细胞凋亡检测。
1.4.4 bcl-2、bax、caspase-3基因表达取对数生长期T24细胞,用野蔷薇果提取物(终浓度为0.05 g/mL),继续培养 48 h。取50 μL滴在载玻片上,用丙酮溶液(4℃)将细胞覆盖,4℃固定细胞20 min。依据试剂盒说明进行免疫组化检测。以细胞浆或胞膜出现棕黄色高出背景的细胞为阳性细胞,每张片子随机选择5个区域,计数阳性细胞和阴性细胞数,分别计算阳性表达率:阳性表达率=阳性细胞数/(阳性细胞数+阴性细胞数)× 100。
1.5 统计分析采用SPSS统计软件进行方差分析,组间比较用t检验。
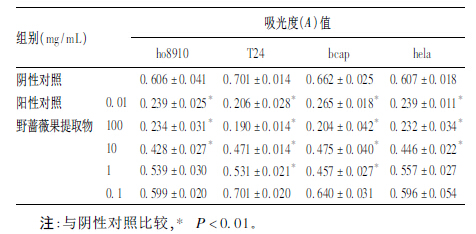
2 结 果 2.1 体外抗肿瘤实验(表 1)| 表 1 野蔷薇果提取物对肿瘤细胞影响(A) |
野蔷薇果提取物浓度在1~ 100 mg/mL范围内对4株细胞生长均有较强的抑制作用;当野蔷薇果提取物浓度降至0.1 mg/mL时,T24、bcap、hela 3种肿瘤细胞未见明显抑制作用。
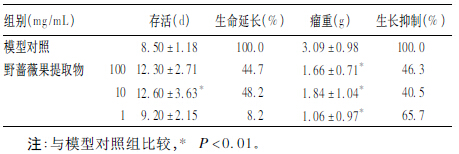
2.2 体内抗肿瘤实验(表 2)| 表 2 野蔷薇果提取物对S180 腹水瘤小鼠存活 的影响(x ± s,n = 10) |
野蔷薇果提取物高、中剂量组小鼠平均存活天数明显高于模型组(P < 0.05);野蔷薇果提取物高、中、低剂量组小鼠平均瘤重明显小于模型对照组(P <0.01)。
2.3 肿瘤细胞凋亡未干预肿瘤细胞核大、边界规则整齐,染色质均匀分布发出淡绿色荧光细胞核;用顺铂处理后,可见大量的凋亡小体发出强绿色荧光;提取物处理肿瘤细胞后,可见部分细胞核固缩,少量凋亡小体。阴性对照Hela,Bcap-37,Ho8910和T24细胞凋亡率分别为8.2%,7.4%,6.0%和 4.7%,野蔷薇果提取物处理组细胞凋亡率分别为16.7%,55.6%,68.6%和72.0%。
2.4 T24细胞bcl-2、bax、caspase-3基因表达提取物处理 T24细胞48 h后,bax、caspase-3基因表达分别为(24.89 ± 1.70)和(18.53 ± 1.41),明显高于阴性对照组(P < 0.01);bcl-2基因表达为(26.60 ± 1.87),明显低于阴性对照(37.43 ± 2.12) (P < 0.01)。
3 讨 论体内外实验4株肿瘤细胞株经野蔷薇果提取物作用后,形态学观察结果提示野蔷薇果提取物诱导了4株肿瘤细胞的凋亡,定量分析证实了野蔷薇果提取物可诱导4株肿瘤细胞的早期凋亡,结果动物实验表明提取物可以抑制S180实体瘤小鼠肿瘤生长,延长腹水瘤小鼠生存时间。野蔷薇果提取物抑制肿瘤生长。研究表明,caspase-3、bcl-2、Bax基因是调控细胞凋亡的重要基因,其中,caspase-3、Bax的高表达可以促进细胞的凋亡,而Bax的高表达则抑制细胞的凋亡,Bcl-2/ Bax比值对决定细胞是否进入凋亡状态有重要意义〔4, 5, 6, 7, 8, 9〕。本实验中观察到野蔷薇果提取物下调bcl2基因蛋白表达和上调bax基因蛋白表达,Bcl2/Bax降低。结合caspase基因蛋白表达检测结果,提示野蔷薇果提取物可能通过下调bcl2表达和上调bax的表达,诱导肿瘤细胞高表达caspase-3,激活内源性核酸内切酶,通过造成肿瘤细胞DNA裂解诱导肿瘤细胞凋亡来发挥其抗肿瘤作用。
| 〔1〕 | 钟承民,付德润,马龙,等.新疆22种食用野生植物抗诱变研究[J].新疆医学院院报,1997,20(2):88-90. |
| 〔2〕 | 孙建新,朱虎虎,肖辉,等.4种新疆植物提取物对人肝癌细胞生长抑制作用的研究[J].新疆医科大学学报,2008,3(17):828-830. |
| 〔3〕 | 肖辉,张月明,冷爱枝,等.巴旦杏提取物抗肿瘤作用[J].中国公共卫生杂志,2007,23(8):940-941. |
| 〔4〕 | Horvitz HR.Genetic control of programmed cell death in the nematode Caenorhabditis elegans[J].Cancer Res,1999,59(7 Suppl):1701-1706. |
| 〔5〕 | Lockshin RA,Zakeri Z.Programmed cell death and apoptosis:origins of the theory[J].Nat Rev Mol Cell Biol,2001,2(7):545-550. |
| 〔6〕 | Roy S,Bayly CI,GareauY,et al.Maintenance of caspase-3 proenzymedormancy by anitinsic“safety catch”regulatory tripeptide[J].Proc Natl Acad Sci USA,2001,98(11):6132-6137. |
| 〔7〕 | Lei K,Davis RJ.JNK phosphorylation of Bim-related members of the Bcl2 family induces Bax-dependent apoptosis[J].Proc Natl Acad Sci U S A,2003,100(5):2432-2437. |
| 〔8〕 | Martinez-Arribas F,Nunez-Villar MJ.Lucas AR,et al.Immunofluorometric study of Bcl-2 and Bax expression in clinical fresh tumor samples from breast cancer patients[J]. Anticancer Res,2003,23 (1B):565-568. |
 2010, Vol. 26
2010, Vol. 26