昆虫离子通道具有多样性,其神经元与骨骼肌中非突触钠通道主要选择性允许钠离子跨膜通过,开放性受电压控制,被称为电压门控性钠通道,其主要功能是维持细胞膜兴奋性及其传导。细胞膜钠离子通道结构和功能正常是生理活动基础,钠通道基因突变或异常表达会导致其激活、失活功能异常,引起组织功能紊乱,甚至会诱发疾病。同时钠通道也是许多天然神经毒素和杀虫剂靶标〔1, 2〕。本文就昆虫非突触离子通道钠通道结构、基本功能和调节机制方面研究进展进行综述,为农药杀虫机制研究提供科学依据。
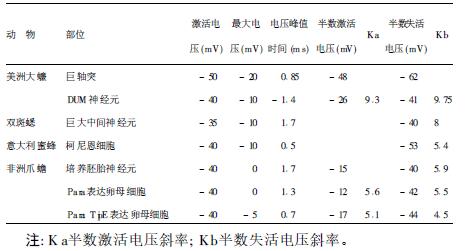
1 阿米洛利敏感型钠通道 1.1 遗传和结构信息(图 1)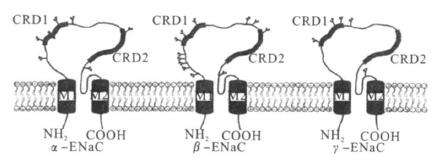 | 注: M 1和M2 表示跨膜片段; CRD1 和CRD2 表示富含半胱氨酸的结构域; 糖基化位点分别在ENaC (α6、β12、τ5) ; CRD1填充位 点显示的6 氨基酸区域为阻断阿米洛利区域〔7〕。图 1 EN aC亚单位的结构模型( α、β、τ) |
阿米洛利敏感型钠通道属于结构相似的阳离子通道家族,根据首次发现的秀丽隐杆线虫亚科退行蛋白家族和脊椎动物上皮细胞的阿米洛利敏感型钠通道称之为上皮细胞钠通道(ENaC)/退化素(DEG)家族(图 1)。进一步研究发现,它们也存在于其他神经和肌肉细胞中。这些通道具有广泛功能〔3〕,可能参与机械传导〔4〕或者参建离子肽受体〔5, 6〕。如果蝇周围神经系统阿米洛利敏感型钠通道参与机械传导。果蝇dmdNaC1基因编码的阿米洛利敏感型钠通道基因产物有2个被半胱氨酸富含域隔开的跨膜部分〔8〕,其基因产物与其他家族成员相关性较低(<20%)。果蝇性腺和早期胚胎的dGNaCl蛋白(38%)除外。
1.2 电生理调节果蝇神经元后期表达扒手基因或dmd-NaCl型阿米洛利敏感型钠通道〔7, 8〕。dmdNaCl表达的爪蟾卵母细胞未记录到激活电流,细胞外pH值未下降,蛋白激酶A和C也未激活,应用酰胺不产生激活电流。可能必须通道亚基和一些辅助蛋白质共表达才能激活通道。然而,同一系统中dGNaCl表达却能够获得功能通道〔8〕通透Na+和Li+,电导可被阿米洛利(IC50=24〔mol/L)或其衍生物阻断。应用三磷酸腺苷,细胞外pH值减小,激活蛋白激酶A和C不改变电流。
2 电压门控钠通道整个昆虫神经系统普遍表达电压门控钠通道,例如烟草天蛾的嗅觉受体神经元〔9〕。但是,有少数神经元即使是轴突〔10〕也不表达任何种类的钠通道;果蝇的中枢神经细胞在出生16h后就可以记录到钠电流〔11〕。除果蝇体壁肌肉〔12〕,其他昆虫肌肉细胞钠通道未见报道。
2.1 基因和结构 2.1.1 亚基变色(DSC1)基因〔13〕和帕拉(para)基因〔14〕编码果蝇钠通道α亚基。这些基因与大鼠钠通道编码基因〔15〕极为相似。在果蝇神经系统里,para基因变异导致钠通道改变〔16〕。para转录物可以在5个位点进行可变剪接,产生48个不同的剪接变异体,从而构成不同的钠通道同工酶〔17〕。氧化剂可以改变钠通道的甲硫氨酸和半胱氨酸残基而导致抑制钠电流失活〔18〕。家蝇钠通道Vssc1基因与果蝇的para基因同源,德国小蠊的编码基因与para的α亚基有关〔19〕,烟草蚜虫〔20〕的para基因和DSC1基因,hscp基因和hDSC1基因同源。利用I型大鼠脑钠通道(SP19)抗体〔21〕鉴定蝗虫、美国大蠊、蚜虫和丽蝇的神经钠通道α亚基,其分子量范围240~280kd〔22〕。
2.1.2 β亚基钠通道除了大的α亚基,还有2个较小的辅助亚基β1和β2。α亚基形成离子通道,β亚基在调节通道功能中起着关键作用。果蝇tipE基因蛋白的功能类似于脊椎动物钠通道.1亚基,调节钠通道para基因产物〔23〕。tipE基因参与调控果蝇的钠电流,实验证明,各种tipE基因突变引起钠电流密度改变〔24〕。
2.2 定位蜚蠊腹部终端神经节(TAG)里的未知神经元、飞蛾的运动神经和蜜蜂大脑凯尼恩细胞都检测到了钠电流。钠通道通常在轴突表达,它们在体细胞一般不表达。利用SP19抗体对背侧不成对中间神经元(DUM)细胞末端神经节免疫荧光染色,胞体靠近轴突始段部分表现出高密度钠通道
2.3 电生理特性(表 1)| 表 1 神经元电压门控钠通道的电生理参数 |
首先被研究的是蜚蠊巨轴突的钠电流〔25〕,后来研究证明乌贼轴突也有类似钠电流。不同昆虫物种(例如苍蝇、蜜蜂或蜚蠊)钠电流激活电压依赖性变化很小。而且特定基因表达钠通道类似天然细胞钠通道,没有观察到时间依赖性INa电流。
蜚蠊轴突去极化导致快速激活、失活。然而,有些蜚蠊腹侧DUM神经元胞体显示,除了快速失活的部分(激活电压-40mV),有一部分电流(激活电压≤-90mV)几乎没有失活(给予50ms持久测试脉冲)。另2个部分能够被海藻毒素所阻断〔26〕,在蜜蜂凯里恩细胞观察到快速和慢速2种河豚毒素敏感型钠电流。同样,在培养的巨型果蝇神经元(有别于细胞停止分化的胚胎神经母细胞)和果蝇神经元共同存在快速和慢速河豚毒素敏感型钠电流。2种电流的稳态激活参数相同。对蜚蠊腹侧末端第5和第6神经节DUM细胞胞体进行详细钠电流动力学研究〔26〕发现,激活的快速部分符合H-H模型:对激活时间过程拟合,失活最佳拟合时间常数是τh1=1ms,τh2=9.3ms(最大峰值电流)。快速失活和激活的时间常数几乎是相同的(tm=1.25ms)。
2.4 钠离子通道神经毒素及其结合部位钠通道有至少6个位点可以结合神经毒素,根据门控过程将作用于电压门控离子通道的神经毒素分为2种类型:阻断型和调节型,分别起到阻断、调节钠通道作用〔27〕。神经毒素杀虫效应得到了广泛研究〔28, 29〕。神经毒素对脊椎动物和昆虫钠通道的易感性没有本质区别;钠通道在进化过程中高度保守〔30〕。不同的昆虫钠通道结合部位之间以及昆虫(和其他无脊椎动物)及脊椎动物钠通道结合部位之间还是有一定的区别:(1)昆虫钠通道一般比脊椎动物钠通道对河豚毒素更敏感,也有部分例外〔31〕;(2)ω型毒素不影响哺乳动物钠通道,但#蜘蛛毒素和海蜗牛ω-芋螺毒素却能加速蜚蠊DUM神经元的钠通道失活〔32〕;(3)蜘蛛毒素与某些已知部位结合产生毒性,并且具有高度昆虫选择性;(4)昆虫选择性毒素根据不同的昆虫种属区分钠通道。例如,蝎毒素对蜚蠊、蝗虫、丽蝇和鳞翅目膜显示出不同毒性作用〔33〕。
2.5 调节飞蝗、蜚蠊、蚜虫和丽蝇神经钠通道能够通过cAMP依赖蛋白激酶与SP19抗体发生免疫反应〔34〕。神经激素D类属于昆虫脂肪动员家族的昆虫激素神经肽,它们能够影响美洲大蠊DUM神经元钠电流加速可逆失活,有效地减少电流。神经肽缩短失活时间常数τh和延长复活时间常数,稳态激活和失活参数以及激活时间常数τm不受影响。激素的影响与8-溴环磷酸腺苷作用类似并且可以被蛋白激酶A催化;细胞与蛋白激酶A抑制剂共培养后,多肽对细胞无影响,该调节可能是由于蛋白激酶A介导的通道磷酸化。蜚蠊表达的机械感受神经元(触觉脊柱)是个典型的例子,其在100ms内适应,是一个缓慢的钠失活过程,对α受体拮抗剂酚妥拉明敏感〔35〕。
3 钠背景电流蜚蠊DUM神经元经过短期培养后记录到河豚毒素敏感型钠电流〔36〕,鉴于毒素作用的观点,该通道至少对电压门控钠通道有一些药理特性。
3.1 定位和电生理特性细胞贴附式膜片钳技术显示钠背景电流发生于胞体。其电导斜率为36ps;钳制电压为-70~-30mV,通道随机开放,突发动作电位出现在-70mV。开放概率有一个钟形电压依赖性,例如:在神经细胞静息电位-50mV附近,最大开放概率只有0.008。电压在-70~-30mV,开放时间常数在0.1~0.2ms。
3.2 毒理目前的钠背景电流不仅只对河豚毒素敏感(完整阻断浓度为100nmol/L),2种α蝎毒素能够结合电压依赖性钠通道结合位点。昆虫选择性α蝎毒素LqhαIT(10nmol/L)在-50mV时从单通道开始激活,100nmol/L毒素减少激活的关闭。
4 小结昆虫非突触钠通道自从首次在果蝇中克隆,近25年中已有许多其他种类的昆虫钠通道被分离克隆。特别是昆虫钠通道在爪蟾卵母细胞中的成功表达以及TipE作为辅助亚基的鉴定,推动了昆虫钠通道的研究。近年来阐明了选择性剪接和RNA编辑2种机制在昆虫钠通道多样性中的作用。昆虫钠通道突变的发现,推动了昆虫杀虫剂抗药机制的认识,昆虫钠通道与昆虫对杀虫剂抗药性的关系已成为研究热点。钠通道作为神经毒素和杀虫剂的重要靶点,对探明各种神经毒素的作用机制、开发利用新型杀虫剂具有重要理论意义和应用价值。
| 〔1〕 | 许鹏,孙芹,陈超,等.美洲大蠊中枢DUM神经元的分离和电压门控Na+电流的记录[J].昆虫学报,2009(4):380-385. |
| 〔2〕 | 张志红,屈卫东,蒋颂辉,等.类毒素-A对小鼠中枢神经系统的毒性[J].中国公共卫生,2006,22(1):41-42. |
| 〔3〕 | Benos DJ,Stanton BA.Functional domains within the degenerin:epithelial sodium channel(Deg:ENaC)uper family of ion channels[J].Physiol(Lond),1999,520:631-644. |
| 〔4〕 | Lingueglia E,Renard S,Voilley N,et a.l Molecular cloning and functional expression of different molecular forms of rat amiloride binding proteins[J].Eur Biochem,1993,216:679-687. |
| 〔5〕 | Cottrell GA.The first peptide gated ion channel[J].Exp Biol,1997,200:2377-2386. |
| 〔6〕 | Akaike N,Ueno S.Proton induced current in neuronal cells[J].Prog Neurobiol, 1994,43:73-83. |
| 〔7〕 | Adams CM,Anderson MG,Motto DG,et a.l Ripped pocket and pickpocke,tnovel Drosophila DEG:ENaC subun its expressed in early development and in mech anosen sory neurons[J].Cell Biol,1998,140:143-152. |
| 〔8〕 | Darboux,ILingueglia E,Pauron D,et al. A new member of the amiloride sensitive sodium channel family in Drosophila melanogaster peripheral nervous system[J].Biochem Biophys Res Commun,1998,246(1):210-216. |
| 〔9〕 | Zufall F,Stengl M,Franke C,et al. Ionic currents of culturedol factory receptor neurons from antennae of male Manduca sexta[J].Neurosci, 1991,11:956-965. |
| 〔10〕 | Haag J,Theunissen F,Borst A.The intrinsic electrophysiological characteristics of fly lobula plate tangential cells:I.IA ctivemem brane properties[J].Comput Neurosci, 1997,4:349-369. |
| 〔11〕 | Ba ines RA,Bate M.Electrophysiological development of central neurons in the Drosophila embryo[J].Neurosci, 1998,18:4673-4683. |
| 〔12〕 | Yamaoka K,Ikeda K.Electrogenic responses elicited by transmem brane depolarizing currentin aerated body wallm uscles of Drosophila melanogaster larvae[J].Comp Physiol, 1988,163:705-714. |
| 〔13〕 | Yao WD,Wu CF.Auxiliary hyperkinetic beta subunit of K channels:regulation of firing properties and K currents in Drosophila neurons[J].Neurophysiol, 1999,81:2472-2484. |
| 〔14〕 | Yoshikawa S,Miyamoto I,Aruga J,et a.l Isolation of a Drosophila geneen codinga head specific guanylyl cyclase[J].Neurochem,1993,60:1570-1573. |
| 〔15〕 | Yu W,Xu J,Li M.NAB domain is essential for the subunit assembly of both alpha alph a and alpha beta com complexes of shaker like potassium channels[J].Neuron,1996,16:441-453. |
| 〔16〕 | Wicher D.Peptidergic modulation of an insect Nacurrent:role of protein kinase A and protein kinase C[J].Neurophysiol, 2001,85:374-383. |
| 〔17〕 | Wicher D,Penzlin H.Ca2+ currents in cockroach neurones:properties and modulation by neurohorm one D[J].Neuroreport,1994,5:1023-1026. |
| 〔18〕 | WicherD,Penzlin H.Ca2+ currents in central insect neurons:elec trophysiological and pharm acological properties[J].N europhysiol,1997,77:186-199. |
| 〔19〕 | Warmke JW,Reenan RA,Wang P,et al. Punctional expression of Drosophila para sodium channels.Modulation by the membrane protein TipE and toxin pharmacology[J].Gen Physiol, 1997,110(2):93-133. |
| 〔20〕 | Washio H.Effects of putative neurotransm itters on dorsal unpaired median neurons of cock roach(Periplaneta americana)thoracic ganglia[J].Insect Physiol, 1994,40:841-847. |
| 〔21〕 | Washio H,Tanaka Y.Some effects of octopamine,proctolin and seroton in on dorsa lunpaired median neurones of cockroach(Periplaneta americana)thoracic ganglia[J].Insect Physiol, 1992,38:511-517. |
| 〔22〕 | Weckstrm M,Hardie RC,Laughlin SB.Voltage activated potassium channels in blow flyphotorecep tors and their role in light adaptation[J].Physiol, 1991,440:635-657. |
| 〔23〕 | Wallner M,Meera P,Toro L.Molecular basis of fast inactivation in voltage and Ca2+ activated K+ channels:a transm embrane betasubun it homolog[J].Proc Natl A cad Sci USA,1999,96:4137-4142. |
| 〔24〕 | Walther C,Schiebe M.FMRF-NH2-like factor from neurohaemal organ modulates neuromu scular transm ission in the locust[J].Neurosci Lett,1987,77:209-214. |
| 〔25〕 | Amat C,Lapied B,French AS,et a.l Na Dependent neuritic spikes in itiate Ca2-dependent somatic plateauaction potentials in insect dorsal paired median neurons[J].Neurophysiol, 1998,80:2718-2726. |
| 〔26〕 | Lapied B,Malecot CO,Pelhate,M.Patch clamp study of the properties of the sodium current in cock roach single isolated adult aminergic neurons[J].Exp Biol, 1990,151:387-404. |
| 〔27〕 | CatterallWA.Cellular andmolecular biology of voltagegated sodium channels[J].Physiol Rev,1992,72:S15-S48. |
| 〔28〕 | Pelhate M,Sattelle DB.Pharmacological properties of insect axons: a review[J].Insect Physiol, 1982,28:889-903. |
| 〔29〕 | Narahashi T,Ginsburg KS,Nagata K,et a.l Ionchannels as targets for insecticides[J].N eurotoxicology,1998,19:581-590. |
| 〔30〕 | Strong M,Chandy KG,Gumtan GA.Molecular evolution of voltagesen sitive ion channel genes:on the origins of electrical excitability[J].Mol Biol Evol, 1993,10:221-242. |
| 〔31〕 | Zlotkin E.The insect voltage gated sodium channel as target of in secticides[J].Annu Rev Entomol, 1999,44:429-455. |
| 〔32〕 | Wicher D,Penzlin H.Omega toxins affect Nacurrents in neurose cretory in sect neurons[J].Receptors Channels,1998,5:355-366. |
| 〔33〕 | Moskowitz H,Herrmann R,Zlotkin E,et a.l Variability among in sect sodium channels revealed by select ive neu rotoxins[J].In sect Biochem Mol Biol, 1994,24:13-19. |
| 〔34〕 | Gordon D,Moskowitz H,Zlotkin E.Sodium channel polypeptides in central nervous systems of various in sects identified withsitedi rected antibodies[J].Biochmi Biophys Acta,1990,1026:80-86. |
| 〔35〕 | Wicher D.Peptidergic modulation of an insect Na current:role of protein kinase A and protein kinase C[J].Neurophysiol, 2001,85:374-383,80-86. |
| 〔36〕 | Lapied B,Stankiewicz M,Grolleau F,et a.l Biophysica lproperties of scorpion alpha toxinsen sitive background sodium channel contributing to the pacemaker activity in insect neu rosecretory cells(DUM neurons)[J].Eur J Neurosci, 1999,11:1449-1460. |
 2010, Vol. 26
2010, Vol. 26